Ричард Роудс - Создание атомной бомбы
- Название:Создание атомной бомбы
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2020
- Город:Москва
- ISBN:978-5-389-18917-1
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ричард Роудс - Создание атомной бомбы краткое содержание
В формате PDF A4 сохранён издательский дизайн.
Создание атомной бомбы - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Помощь пришла с неожиданной стороны. Дж. У. Николсон, профессор математики в Королевском колледже Лондона, которого Бор считал глупцом, опубликовал несколько статей, в которых для объяснения необычного спектра солнечной короны предлагалась квантованная сатурнианская модель атома. Статьи эти были опубликованы в астрономическом журнале в июне; Бор увидел их только в декабре. Он быстро нашел недостатки модели Николсона, но в то же время почувствовал, что другие исследователи идут за ним по пятам, – а также отметил, что Николсон углубился в дебри спектральных линий.
Ориентируясь на химию, обмениваясь идеями с Дьёрдем де Хевеши, Бор не думал о том, что доказательства в поддержку его модели атома можно искать и в спектроскопии. «Спектры были очень сложной задачей, – сказал он в своем последнем интервью. – …Они казались великолепными, но в них не было видно возможностей для развития. Точно так же, если взять крыло бабочки, на нем, конечно, можно увидеть замечательно регулярные узоры, цвета и так далее, но никому не придет в голову, что по окраске крыла бабочки можно понять основы биологии» [328] Цит. по: Heilbron and Kuhn (1969), p. 257, прим. 117.
.
Воспользовавшись подсказкой Николсона, Бор обратил теперь свое внимание на крылья спектральной бабочки.
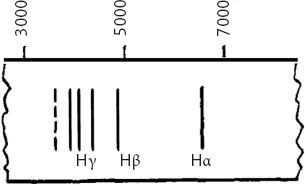
В 1912 году спектроскопия была хорошо развитой областью. Первым эффективно исследовал ее шотландский физик XVIII века Томас Мелвилл. Он смешивал химические соли со спиртом, поджигал эти смеси и рассматривал полученный свет через призму. Разные химические элементы давали пятна разных цветов. Отсюда возникла идея использования спектров для химического анализа, для идентификации неизвестных веществ. Призматический спектроскоп, изобретенный в 1859 году, был важным научным достижением. В нем использовалась узкая щель, установленная перед призмой, чтобы превратить световые пятна в узкие полоски сравнимой ширины; эти полоски можно было отобразить на линейке с делениями (а впоследствии – на ленте фотопленки), чтобы измерить расстояния между ними и вычислить длины волн света. Такие характеристические наборы линий стали называть линейчатыми спектрами. У каждого элемента имеется свой уникальный линейчатый спектр. Гелий был открыт в виде серии необычных линий в хромосфере Солнца в 1868 году, за двадцать три года до того, как его обнаружили в составе урановой руды на Земле. Линейчатые спектры оказались предметом полезным.
Однако никто не понимал, что́ порождает эти линии. В лучшем случае математикам и спектроскопистам, любившим заниматься численным выражением длин волн, удавалось найти в наборах спектральных линий красивые и гармоничные закономерности. В 1885 году швейцарский математик и физик XIX века Иоганн Бальмер нашел одну из самых основных формул – формулу для вычисления длин волн спектральных линий водорода. Эти линии, образующие так называемую серию Бальмера, выглядят следующим образом:
Серия Бальмера
Не обязательно разбираться в математике, чтобы оценить простоту выведенной Бальмером формулы, которая предсказывает положение любой линии в спектре с точностью до одной тысячной. В этой формуле содержится всего одно произвольное число:
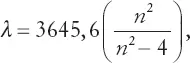
где греческая буква λ (лямбда) обозначает длину волны линии, а n принимает для разных линий значения 3, 4, 5 и так далее. При помощи этой формулы Бальмер смог предсказать ожидаемые длины волн линий еще не изученных участков спектра водорода. Впоследствии такие линии были найдены именно там, где они должны были быть по его расчетам.
Шведский спектроскопист Йоханнес Ридберг превзошел достижение Бальмера, опубликовав в 1890 году общую формулу, справедливую для огромного числа разных линейчатых спектров. Формула Бальмера стала частным случаем более общей формулы Ридберга, в основе которой лежало число, названное постоянной Ридберга. Это число, впоследствии измеренное различными способами и ставшее одной из наиболее точно известных фундаментальных постоянных, по современным измерениям равно 10973731,568508 м –1 [329] Значение постоянной Ридберга, рекомендованное в 2014 г. международным комитетом по данным для науки и техники (CODATA).
.
Эти формулы и числа могли быть известны Бору из университетского курса физики, особенно с учетом того, что Кристиансен был поклонником Ридберга и досконально изучил его работы. Но спектроскопия была далека от области интересов Бора, и можно предположить, что он о них просто забыл. Он нашел своего старого друга и одноклассника Ханса Хансена, физика и спектроскописта, который только что вернулся из Гёттингена. Вместе с Хансеном они просмотрели материалы по регулярности линейных спектров. Бор нашел соответствующие числа. «Как только я увидел формулу Бальмера, – говорил он впоследствии, – мне всё немедленно стало ясно» [330] Цит. по: Ibid., p. 265.
.
А именно ему немедленно стала ясна связь между его электронами на орбитах и линиями светового спектра. Бор предположил, что электрон, связанный с ядром, в нормальном состоянии занимает устойчивую базовую орбиту, которую называют основным состоянием. При поступлении в атом дополнительной энергии – например при нагревании – электрон перескакивает на более высокую орбиту, то есть в одно из более высокоэнергетических состояний, и оказывается на большем удалении от ядра. При дальнейшем поступлении энергии электрон продолжает перескакивать на все более высокие орбиты. Если поступление энергии прекращается – если оставить атом в покое, – электроны начинают перескакивать обратно в свои основные состояния:
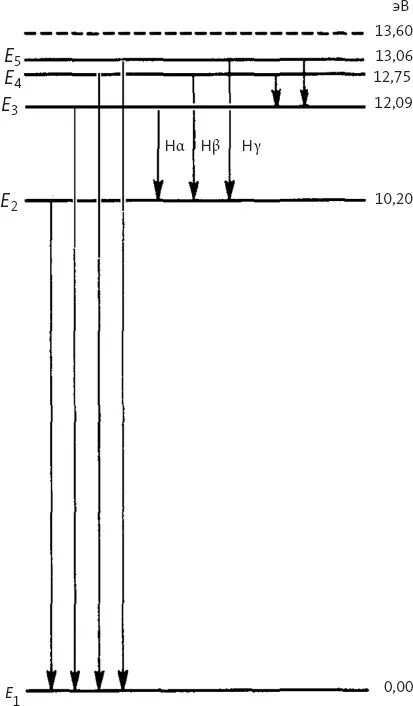
При каждом таком скачке электрон испускает фотон с соответствующей энергией. Скачки – а следовательно, и величины энергии фотонов – задаются постоянной Планка. Вычитание энергии W 2более низкого устойчивого состояния из энергии W 1более высокого устойчивого состояния дает величину, в точности равную энергии света, то есть h ν.
Из этого изящного упрощения, W 1– W 2= h ν, Бору удалось вывести серию Бальмера. Оказалось, что линии серии Бальмера точно соответствуют энергии фотонов, которые электрон водорода испускает при скачках с одной орбиты на другую в направлении основного состояния.
После чего, совершенно поразительным образом, из несложной формулы
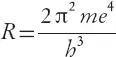
(где m – масса электрона, e – его электрический заряд, а h – постоянная Планка, то есть только фундаментальные значения, а не произвольные числа, выдуманные Бором) Бор получил постоянную Ридберга, причем вычисленное значение совпало с измеренным на опыте с погрешностью менее 7 %! «Ничто на свете не производит на физика более сильного впечатления, – отмечает один американский физик, – чем численное согласие между экспериментом и теорией, и я, бывший свидетелем появления этой формулы, не думаю, что численное согласие в принципе может быть более впечатляющим, чем в этом случае» [331] Darrow (1952), p. 53.
.
Интервал:
Закладка:










