Александр Плонский - Пьезоэлектричество
- Название:Пьезоэлектричество
- Автор:
- Жанр:
- Издательство:Гостехиздат
- Год:1960
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Плонский - Пьезоэлектричество краткое содержание
Пьезоэлектричество - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Кристаллические тела бывают двух видов. Одни из них, имеющие от природы форму многогранников — кубов, пирамид и т. п., — получили название монокристаллов (или просто кристаллов). Другие кристаллические тела не имеют многогранной формы, но если рассмотреть их под микроскопом, то можно заметить, что они состоят из множества мелких, сросшихся между собой монокристаликов. Такие тела называют поликристаллическими.
Большинство горных пород, а также все металлы, относятся к поликристаллическим телам.
Размеры монокристаллов бывают различными. У поваренной соли и сахарного песка кристаллы не больше булавочной головки, кристаллы кварца по величине иногда достигают человеческого роста (рис. 3).

Рис. 3. Такой величины достигают кристаллы кварца.
Распространённость кристаллических веществ в природе чрезвычайно широка. Драгоценный изумруд и обыкновенная слюда, огромные глыбы льда и крошечные снежинки относятся к миру кристаллов. Лишь очень немногие твёрдые тела имеют аморфную структуру, но и они с течением времени обычно начинают кристаллизоваться.
Так, можно наблюдать помутнение стекла. Это происходит в результате образования в стекле кристаликов.
Если сравнить между собой кристаллы разных веществ, то легко заметить, что их форма различна. Например, кристалл поваренной соли имеет форму куба (рис. 4, а ). Кварц кристаллизуется в виде заострённых на концах шестигранных призм (рис. 4, б ).
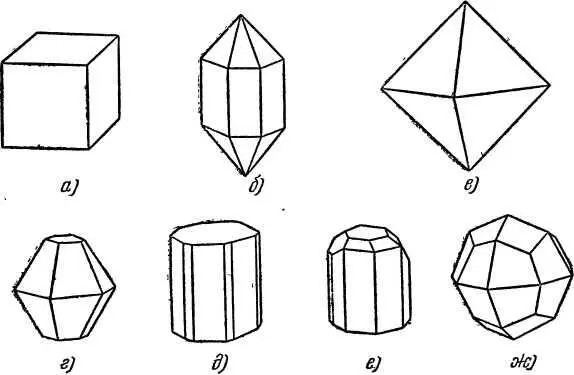
Рис. 4. Различные формы кристаллов: а) поваренная соль, б) горный хрусталь (кварц), в) магнетит, г) корунд, д) берилл, е) топаз, ж) лейцит.
Для сравнения на рис. 4 показаны также кристаллы различных минералов [1] Минерал — химическое соединение, образовавшееся естественным путём.
.
Внешняя форма кристалла зависит от его внутреннего строения — от формы кристаллической решётки и свойств среды, в которой он образуется.
Форма природных кристаллов часто бывает неправильной. Это объясняется тем, что обычно кристаллы развиваются неравномерно, и одни грани вырастают быстрее, а другие медленнее. Однако всем кристаллам одного какого-либо вещества присуще общее свойство: независимо от формы углы между одними и теми же гранями в таких кристаллах строго постоянны. Это свойство кристаллов получило название закона постоянства углов. Закон постоянства углов — один из важнейших законов науки о кристаллах — кристаллографии, основоположником которой является русский учёный Евграф Степанович Фёдоров.

Евграф Степанович Фёдоров .
Как же возникают и развиваются кристаллы?
Рассмотрим образование кристаллической решётки поваренной соли. Из рис. 2 видно, что ионы натрия и хлора в кристаллической решётке расположены по углам кубов не произвольно, а чередуясь через один, в строгом шахматном порядке. Такая закономерность расположения ионов не случайна. В природных условиях поваренная соль кристаллизуется из так называемого маточного рассола соляных озёр. В водном растворе частицы натрия и хлора существуют как в виде разрозненных ионов, так и в составе молекул поваренной соли. Каждая такая молекула состоит из положительного иона натрия и отрицательного иона хлора. Возможны три случая взаимного расположения двух молекул поваренной соли (рис. 5).
Известно, что под воздействием электрических сил разноимённо заряженные тела притягиваются друг к другу, а одноимённо заряженные — взаимно отталкиваются. Поэтому в одном случае (рис. 5, а ) молекулы отталкиваются, в другом (рис. 5, б ) — притягиваются и в третьем (рис. 5, в ) — стремятся повернуться так, чтобы занять устойчивое положение (рис. 5, б ).
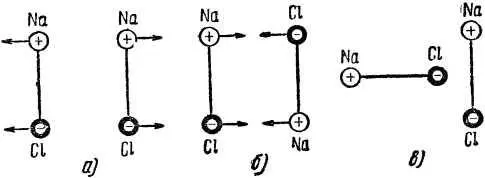
Рис. 5. Возможные взаимные положения двух молекул поваренной соли.
Именно по этой причине молекулы поваренной соли, а также и разрозненные ионы хлора и натрия при кристаллизации группируются между собой, располагаясь таким образом, чтобы расстояния между одноимёнными ионами были как можно большими, а между разноимёнными — как можно меньшими, то есть в шахматном порядке.
Так возникает зародыш кристалла. Постепенно его кристаллическая решётка, образованная чередующимися ионами натрия и хлора, пополняется всё новыми и новыми частицами вещества. Кристалл растёт.
Чтобы представить себе, как происходит рост кристалла, достаточно вспомнить пчелиные соты. Сооружая их, пчёлы отстраивают ячейку за ячейкой, слой за слоем, как это показано на рис. 6.
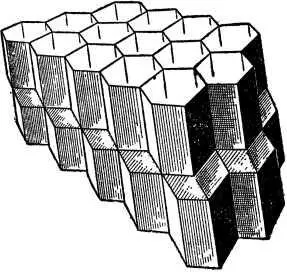
Рис. 6. Пчелиные соты.
Приблизительно так же растёт и кристалл. Новые слои вещества откладываются на гранях зародыша так, что грани передвигаются параллельно самим себе (рис. 7).
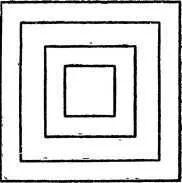
Рис. 7. Так передвигаются грани кристалла при его росте.
Если зародыш имел форму куба, то такую же форму будет иметь и выросший кристалл, при условии, что грани развивались равномерно.
Кристаллы могут образовываться из жидкого, твёрдого и газообразного состояний вещества. Так, снежинки — это кристалики льда, образовавшиеся из парообразного состояния воды. Кристаллизация стекла — пример образования кристаллов из твёрдого состояния.
Но проще всего получить кристалл из раствора.
Растворяя в стакане воды какое-либо растворимое вещество, например ту же поваренную соль, легко заметить, что сначала соль растворяется легко и быстро, затем всё медленнее, и, наконец, перестаёт растворяться. Следовательно, в любом ограниченном объёме воды — в стакане, ведре, бочке и т. д. — можно растворить лишь вполне определённое количество соли. Чем больше объём воды, тем большее количество соли удаётся растворить в ней. Вся же остальная соль, сколько бы её ни подсыпали в раствор, не растворившись, выпадет на дно сосуда в виде осадка. Раствор, содержащий наибольшее возможное количество растворимого вещества, называется насыщенным.
Растворимость соли зависит от температуры. В горячей воде можно растворить гораздо больше вещества, чем в холодной.
Проделайте такой опыт. Растворите 200 граммов белых (алюминиевых) квасцов в таком количестве горячей воды, чтобы на дне сосуда оставалось немного осадка. Затем остудите раствор до комнатной температуры. Поскольку растворимость квасцов при понижении температуры уменьшается, количество осадка увеличится. Вылейте полученный насыщенный раствор в какой-либо сосуд с широким дном и низкими стенками, например, в тарелку. Такая форма сосуда необходима для того, чтобы раствор мог свободно испаряться. При испарении количество воды в сосуде будет постепенно уменьшаться, поэтому уже на следующий день на дне тарелки можно обнаружить осадок, состоящий из мелких кристаликов. Выберите из их числа несколько самых крупных, затем слейте раствор в стакан, тщательно промойте тарелку, наполните её тем же раствором и положите на дно отобранные кристалики.
Читать дальшеИнтервал:
Закладка:

