Владимир Рюмин - Химические опыты
- Название:Химические опыты
- Автор:
- Жанр:
- Издательство:АСТ
- Год:2018
- Город:Москва
- ISBN:978-5-17-109627-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Владимир Рюмин - Химические опыты краткое содержание
Для среднего школьного возраста.
Химические опыты - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Вероятно, около полутора миллионов куб. футов кислородного газа таким образом сразу вылилось в воздух. Эта катастрофа была простым повторением, только в огромных размерах, одного из приключений, которые происходят со всяким, начинающим практически изучать химию, именно при приготовлении кислорода нагреванием бертолетовой соли».
Не правда ли, лучше кислород добывать как-нибудь иначе, безопаснее? Да!
И я советую получить его действием марганцево-кислого калия на перекись водорода.
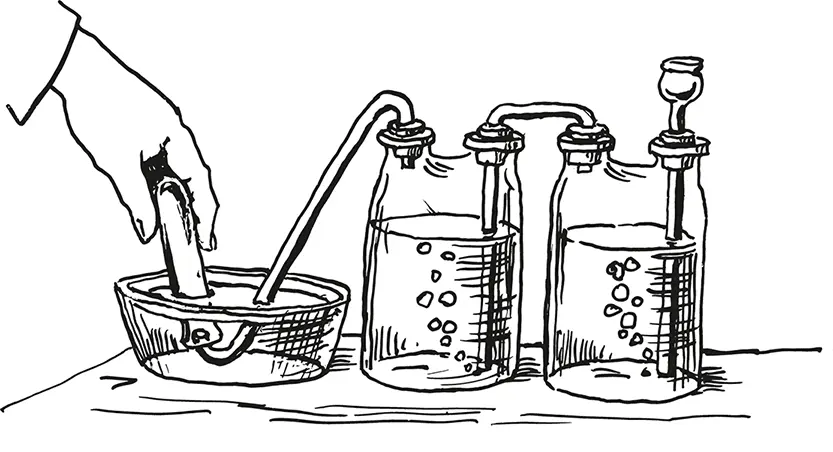
Добывание кислорода
То и другое легко достать в любой аптеке. Крепкий раствор перекиси водорода влейте в колбу с воронкой или двугорлую склянку, всыпьте туда же марганцево-кислого калия и собирайте выделяющийся кислород в цилиндры или бутылки, наполненные водой и опрокинутые отверстием вниз, в пневматическую ванну, — словом, так, как собирали водород. Только, вынимая из ванны сосуды с газом, ставьте их отверстием вверх, прикрывая матовой стеклянной пластинкой, потому что кислород немного тяжелее воздуха.
Горящее железо
Обернув вокруг карандаша тонкую отожженную железную проволоку, насаживают на ее конец кусочек пробки, зажигают последнюю и опускают проволоку в сосуд с кислородом. Можно прямо вколоть свободный конец проволоки в мягкую пробку и закрыть ею склянку с газом. На дне склянки надо оставить немного воды, то есть, собирая в нее выделяющийся кислород, не вытеснять им из сосуда всю воду. В этом случае окалина (продукты горения железа), получающаяся при сгорании железа, остывает в воде, а иначе дно склянки может лопнуть.
Наберите кислорода в бутыль из темно-зеленого стекла и зажгите в нем ленточку магния (через белое стекло свет будет так ярок, что может повредить глазам).
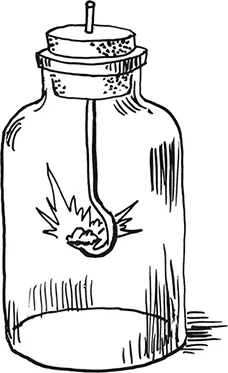
Горение железа в кислороде
Влейте в сосуд воды, хорошенько взболтайте с образовавшимся порошком окиси магния и через некоторое время попробуйте, как говорят химики, реакцию жидкости. Несмотря на ничтожную растворимость окиси магния в воде (с образованием гидрата окиси), реакция будет слабощелочная. Лакмусовая бумажка окрасится в синеватый цвет. Это показывает, до чего чуток лакмус к кислотам и щелочам, так как одна весовая часть окиси магния растворяется только в 55 000 частей воды.
Подумайте, как же, значит, ничтожно ее количество в том объеме воды, который находится на дне вашей склянки!
Ошибка Жюля Верна
В романе Жюля Верна «Таинственный остров» есть такие строки: «Затем руда и уголь были размещены чередующимися слоями — слой руды на слое угля и т. д. Теперь, после того как уголь будет зажжен и в кучу станут нагнетать воздух мехами, в ней должны произойти следующие химические процессы: под влиянием обильного притока кислорода воздуха уголь, сгорая, превращается в углекислоту. Углекислота же, воздействуя на руду окиси железа, отнимает от нее частицу кислорода и таким образом выделяет из нее чистое железо».
Ошибся на этот раз Жюль-Верн!
Углекислота, правильнее — угольный ангидрид — предельное соединение углерода с кислородом. Оно от окиси железа отнять кислород не может. В действительности при неполном сгорании углерода образуется окись углерода, которая и отнимает от руды кислород, превращаясь в угольный ангидрид.
Выделяющееся железо не чисто, оно содержит примесь углерода.
Живые мертвецы
Гораздо легче окрасится лакмусовая бумага в синий цвет, если повторить последний опыт, заменив магний калием или натрием. Это очень легкие (легче воды) серебристо-белые в свежем разрезе, мягкие как воск металлы, которые, подобно кальцию, приходится хранить в керосине. Они также выделяют из воды водород, но эта реакция идет у них еще энергичнее, сопровождаясь таким нагреванием, что выделяющийся газ загорается, а с ним вместе начинают гореть и сами металлы. Мы не станем проделывать этот опыт и вам не порекомендуем, — он зачастую сопровождается небольшим взрывом, который опасен тем, что едкая жидкость может брызнуть в глаза и причинить непоправимое несчастье. Я сейчас хочу показать другой опыт.
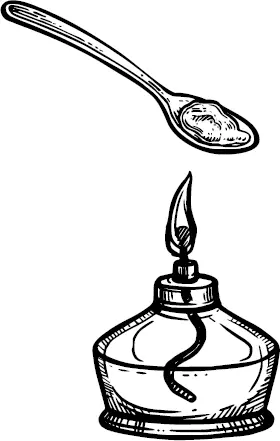
Осторожно, не касаясь натрия руками, вынув его пинцетом из баночки, отделяю ножом кусочек величиной в мелкую горошину, удаляю с него керосин пропускной бумагой, кладу металл в железную ложечку, нагревая в пламени спиртовой лампочки.
Натрий загорелся, и я опускаю его в цилиндр с кислородом. Металл горит ярким пламенем.
Взгляните на мое лицо, посмотрите друг на друга. Какие у всех нас страшные, темные лица «мертвецов».
Оглянитесь вокруг. Куда делись яркие краски обстановки? Как бедна окраска всех окружающих нас предметов!
Таково действие лучей горящего натрия.
Я обещал вам сказать, что такое основания.

Горение натрия
Начать с того, что слово это является примером многих слов, переживших свое значение. До Лавуазье, выяснившего различие между сложными и простыми веществами, в науке господствовала удивительная гипотеза флогистона, таинственного флюида (истечения), менявшего свойства тел и их тепловое равновесие. Металлы считались соединением землистых веществ, из которых они выплавляются, с флогистоном. Самые вещества эти принимались за простые тела, «основания» металлов.
В действительности это были окислы их, продукты соединения металлов с кислородом.
Когда защитникам флогистона указывали на факты, противоречащие их гипотезе, они отвечали: «тем хуже для фактов», а на замечание, что руда всегда весит больше, чем выплавляемый из нее металл, говорили: «значит, флогистон имеет отрицательный вес».
Мы называем основаниями кислородные соединения металлов, дающие с кислотами соли.
Не все металлические руды — окислы, и не все окислы металлов — основания.
Один и тот же элемент, в зависимости от степени окисления, может давать окислы и основного и кислотного характера. Так, мы еще встретимся в наших дальнейших опытах с солями железа, в которые этот элемент входит и как металл, и как металлоид.
Наиболее резко выраженными основаниями являются окислы щелочных металлов и нашатырный спирт.
Последний, как вы знаете, представляет раствор аммиака в воде, а аммиак (мы еще познакомимся с ним поближе) — это газ, состоящий из азота и водорода.
Читать дальшеИнтервал:
Закладка:









