Владимир Окулов - Энциклопедия юного аквариумиста
- Название:Энциклопедия юного аквариумиста
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Владимир Окулов - Энциклопедия юного аквариумиста краткое содержание
Энциклопедия юного аквариумиста - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Это была теория. Можно ее забыть, если кроме головной боли она ничего не вызывает.
Что нужно помнить:
Чтобы узнать, сколько этого самого pH, то есть водородного показателя в воде, придумали шкалу с делениями от 0 до 14.
Нейтральный показатель pH (наиболее предпочтительный) – это деление под номером 7, ровно посередине шкалы. Пишется это, как мы уже знаем, pH7.
Влево от него идут кислые воды (слабокислая – кислая – сильнокислая), вправо – щелочные (слабощелочная – щелочная – сильнощелочная).
Вот как меняется отношение ионов водорода к ионам гидроксильной группы, если посмотреть на показатели pH:
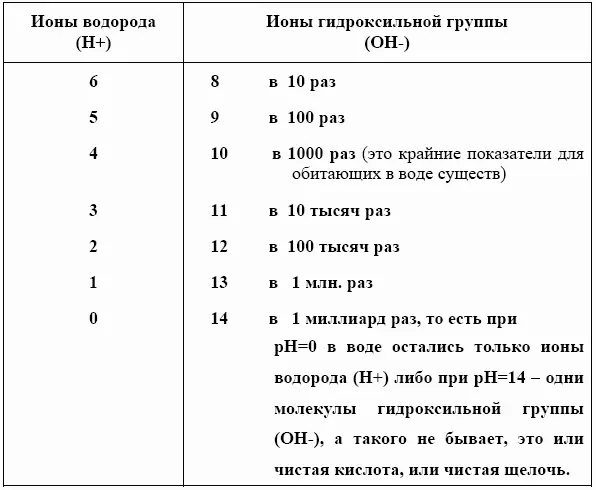
Жизнь в воде возможна в пределах pH 4 – 10. Показатель pH у морской воды равен 8,1–8,3. А вот у пресной воды разброс по шкале сильнее.
Учитывая, что рыбки могут жить в пределах pH от 5 до 9, воду можно разделить так:
pH <5 – сильно кислая,
pH 5–6 – кислая,
pH 6–6,8 слабо кислая,
pH 6,8–7,2 – нейтральная,
pH 7,2–8,0 слабо щелочная,
pH 8,0–9,0 – щелочная,
pH>9 – сильно щелочная.
Показатель pH вообще очень нестабилен: он зависит от температуры воды, от жизнедеятельности растений (значит и от освещения), от того, подвижна ли вода в водоеме или нет.
Разные слои воды могут иметь разный показатель pH. Днем, когда водные растения вырабатывают кислород в процессе фотосинтеза, они подщелачивают воду и pH поднимает вправо по шкале. Но достаточно подуть ветерку над озером, или заработать фильтру в аквариуме, как pH разных слоев уравнивается.
Это еще одна причина, по которой стоячая вода для аквариума – смерть! Потому что без вертикального вращения воды в аквариуме, растения могут так повысить pH в верхних слоях, что у них начнется разрушение листьев и стеблей.
В большинстве случаев показатель pH аквариумной воды колеблется в рамках 6,5–8,5. Но если аквариум сильно загрязнен, давно нечищен и грунт его закис, то водородный показатель у дна может составить и pH 5,5.
Если в аквариуме есть растения, то днем pH, как мы уже говорили, перемещается в щелочную сторону, а ночью, когда они не вырабатывают, а потребляют кислород – в кислую сторону.
Но при всей этой подвижности водородного показателя pH, у обитателей аквариума есть свои рамки. Они называются pH – барьеры. И выход за них в любую сторону по шкале водородного показателя (в кислую или в щелочную) – гибелен.
Так, если перенести аквариумных жителей из одной воды в другую, которые отличаются своим pH больше чем на 0,8–1,0 – то рыбки могут получить сильнейший шок, а у растений начнут отмирать листья и стебли.
Все это происходит потому, что в природе и рыбки, и растения живут в разных условиях. Кто-то в быстрой речке, кто-то в спокойном озере. А раз условия разные, то и pH – барьеры тоже разные.
Если в аквариуме посажены растения с разными pH-барьерами, это может привести к явлению, которое принято называть несовместимостью.
Например, широко распространены в аквариумах три таких растения, как кабомба, валлиснерия и элодея. У кабомбы граница pH-барьера в щелочную сторону заканчивается на 8. В более щелочной воде она прекращает вырабатывать кислород и потреблять углекислый газ (а значит, и расти). У валлиснерии эта граница на pH 10, а у элодеи на pH 11.
Если эти три растения будут вместе, элодея будет подщелачивать верхние слои воды без всякого для себя вреда, а кабомба и валлиснерия не смогут выдержать рядом с ней и будут потихоньку отмирать, потому что при таких показателях pH расти не смогут.
Рыбки тоже сильно реагируют на изменение показателя pH. От его снижения у них может повыситься аппетит, но это такое же обманчивое явление, как и при избытке углекислого газа. На самом деле рыбки не могут усвоить питательные вещества и голодают.
Некоторые рыбки (барбусы и др.) начинают чесаться о грунт и камни, а сомики, несмотря на отменный аппетит, умирают от истощения. Кровь начинает хуже захватывать кислород, и, несмотря на усиленное дыхание, рыбки задыхаются.
Но иногда, чтобы спровоцировать нерест у рыб, нужно изменить им показатель pH на короткий срок. Поэтому при описании рыбок очень часто указывают два необходимых им показателя рН: один нужен для жизни, другой для нереста.
Наиболее подходящая вода для большинства обитателей аквариума должна иметь колебания pH около 7.
Этого достигают, в основном, правильно ухаживая за аквариумом: поддерживают постоянное принудительное ее перемешивание с помощью аэрации и фильтрации, регулярно (обычно еженедельно) меняют часть воды, следят за чистотой в водоеме.
Показатель pH – штука сложная и изменчивая. Попробуй-ка ее определи на глаз! Но есть более стабильный показатель.
Это:
Жесткость воды
Жесткость воды зависит от присутствия в ней растворенных солей кальция (Ca) и магния (Mg).
Жесткость подразделяется на временную, карбонатную (Ca, MgCO3), от которой легко избавиться кипячением, и постоянную, некарбонатную.
Ионы кальция и магния имеют знак «+» и обозначаются как Ca++, Mg++. Они называются катионами и связаны с различными анионами со знаком «-». (Если разделить соль кальция CaCO3, то Ca++ – это катион, а остаток CO3– соответственно анион).
Карбонатная жесткость – это когда катионы связаны с анионами угольной кислоты.
Некарбонатная жесткость – если катионы связаны с анионами хлора, соединениями серы, азота, фосфора, кремния и т. д.
Если значение pH более 8,3, то осадок карбонатов может частично перейти обратно в раствор.
Для измерения жесткости воды аквариумисты пользуются немецкими градусами жесткости dGH (deutsche Gesamt Harte). Общая жесткость здесь обозначается dH или GH, а временная – KH (Karbonat Harte).
Один градус жесткости dGH означает, что в одном литре воды растворено 10 мг CaO.
Для особо дотошных:
В бывшем СССР за единицу жесткости воды принят миллиграмм-эквивалент/литр, то есть 1 мг экв/л равен 20,4 мг кальция или 12,4 мг магния.
Этот показатель отличается от немецкого градуса жесткости, от английского, американского и французского.
1 мг экв/л равен: 2,8 немецкого градуса,
3,5 английского градуса (А),
2,91 американского градуса(Аm)
5,0 французского градуса (ТН).
У общей жесткости воды, так же как у показателя pH, есть своя шкала показателей dH.
Воду разделяют так:
> от 0 до 4 dH – очень мягкая,
> от 5 до 10 dH – мягкая,
> от 11 до 18 dH – средней жесткости,
> свыше 30 dH – очень жесткая.
В природе общая жесткость воды меняется в воде в течение всего года.
Она может увеличиться из-за испарения воды – ведь концентрация солей кальция и магния тогда станет больше. А может уменьшиться из-за дождей, или таяния снега и льда, когда мягкая вода попадет в водоем.
Читать дальшеИнтервал:
Закладка:









