София Романова - Карбонатно-кальциевое равновесие в природных водах
- Название:Карбонатно-кальциевое равновесие в природных водах
- Автор:
- Жанр:
- Издательство:Казахский национальный университет имени аль-Фараби Литагент
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
София Романова - Карбонатно-кальциевое равновесие в природных водах краткое содержание
Карбонатно-кальциевое равновесие в природных водах - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
С. М. Романова
Карбонатно-кальциевое равновесие в природных водах
КАРБОНАТНО-КАЛЬЦИЕВОЕ РАВНОВЕСИЕ В ПРИРОДНЫХ ВОДАХ
Создатель учения о природных водах академик В.И.Вернадский неоднократно подчеркивал, что в природе устанавливаются довольно подвижные равновесия между природными водами, газами и твердыми телами.
Из числа равновесий, которые устанавливаются в природных водах, важнейшим является карбонатно-кальциевое. Основными его компонентами являются: СО 2, Н 2СО 3, НСО 3 -, СО 3 2-, Са 2+, Н +.
Карбонатная система в водоемах и водотоках имеет исключительно важное значение, во-первых, для протекающих в них физико-химических, биологических и других процессов. Во-вторых, состоянием карбонатно-кальциевого равновесия определяются условия растворения или осаждения карбонатов, в частности, СаСО 3. В-третьих, изучение равновесия имеет большое значение для практических целей, например, для характеристики воздействия воды на строительные сооружения из бетона.
Как же возникает равновесие между указанными компонентами? Большая часть СО 2находится в воде в виде молекул растворенного газа и только около 1 % реагирует с водой, образуя угольную кислоту:
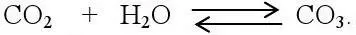
При растворении солей угольной кислоты, происходящей под действием СО 2, в воде появляются ионы СО 3 2-и НСО 3 -. Устанавливается подвижное равновесие:
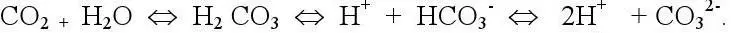
От количественных соотношений между НСО 3 -, СО 3 2-– ионами и СО 2зависит концентрация водородных ионов Н +.
Содержание карбонатных ионов лимитируется концентрацией ионов Са 2+, образующих с ионами СО 3 2-труднорастворимый осадок СаСО 3,растворимость которого определяется произведением активностей:
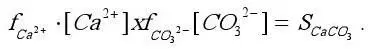
Другим важным компонентом карбонатно-кальциевого равновесия, влияющим на его состояние, является оксид углерода (IV) (Н 2СО 3+ СО 2). Изменение содержания диоксида углерода в воде вызывает сдвиг равновесия в ту или иную сторону. Таким образом, карбонатно-кальциевая система включает в себя ряд равновесий, составляющих общее подвижное равновесие.
Каждое из отдельных равновесий с количественной стороны характеризуется соответствующей константой, определяющей соотношение между концентрациями компонентов при данных условиях. Изменение в одной части общего равновесия вызывает соответствующее изменение во всей цепи. Например, увеличение в воде СО 2понижает значения рН, уменьшает содержание СО 3 2-, в силу чего вода становится ненасыщенной карбонатом кальция.
Согласно современным представлениям схема карбонатно-кальциевого равновесия имеет вид* (по Хорну Р.) [1].
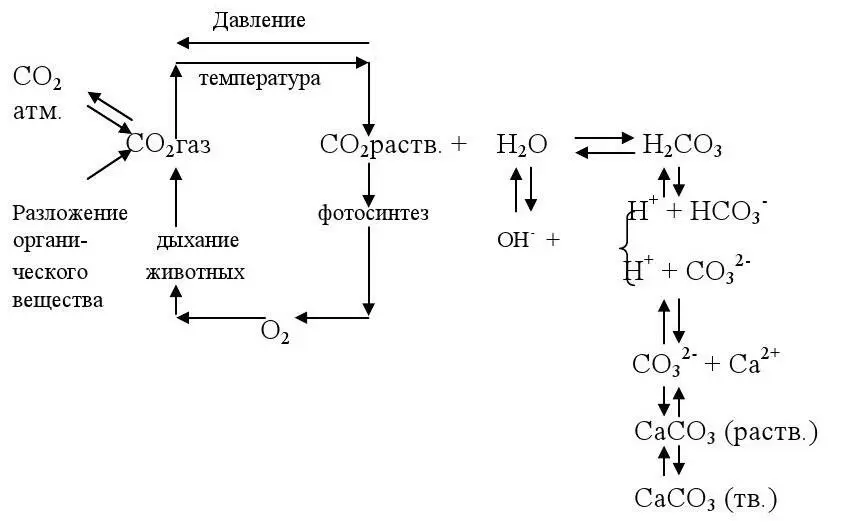
*Линия, соответствующая давлению, направлена по часовой стрелке, температуре – против часовой стрелки.
В присутствии избытка СО 2в раствор переходят ионы НСО 3 -и СО 3 2-до установления нового равновесия между НСО 3 -и СО 2, между СО 3 2-и Са 2+. Наоборот, при уменьшении СО 2повышается значение рН и концентрация СО 3 2-и создается пересыщение воды СаСО 3, которое способствует выделению последнего в осадок.
Изучить состояние равновесия это значит:
1) определить концентрации отдельных компонентов, входящих в уравнение равновесия;
2) установить количественные соотношения между его компонентами;
3) рассмотреть возможность перехода одного компонента в другой;
4) выявить растворимость СаСО 3;
5) возможность перехода компонентов в твердую фазу.
Рассмотрим условия устойчивости карбонатной системы. Основными равновесие СО 2, растворенного в воде с СО 2, находящимся над раствором;
1) соответствие содержания Са 2+и СО 3 2-с величиной произведения активностей этих ионов (S CaCO3) при данных физических условиях и ионной силе раствора:
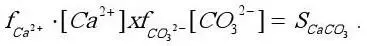
Факторы, определяющие как первое, так и второе условие в природе изменчивы, поэтому легко создаются условия для сдвига равновесия в ту или иную сторону. Для характеристики отклонения данной системы от устойчивого равновесия могут быть использованы две величины:
1) содержание СО 2избыточное против равновесного, т.н. агрессивный оксид углерода ( IV);
2) степень насыщенности воды карбонатом кальция, т.е. величина
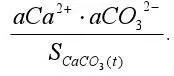
В основе расчета карбонатной системы различных природных вод лежат одни и те же уравнения (таблица 1).
Таблица 1.
Уравнения для расчета карбонатно-кальциевого равновесия [2]
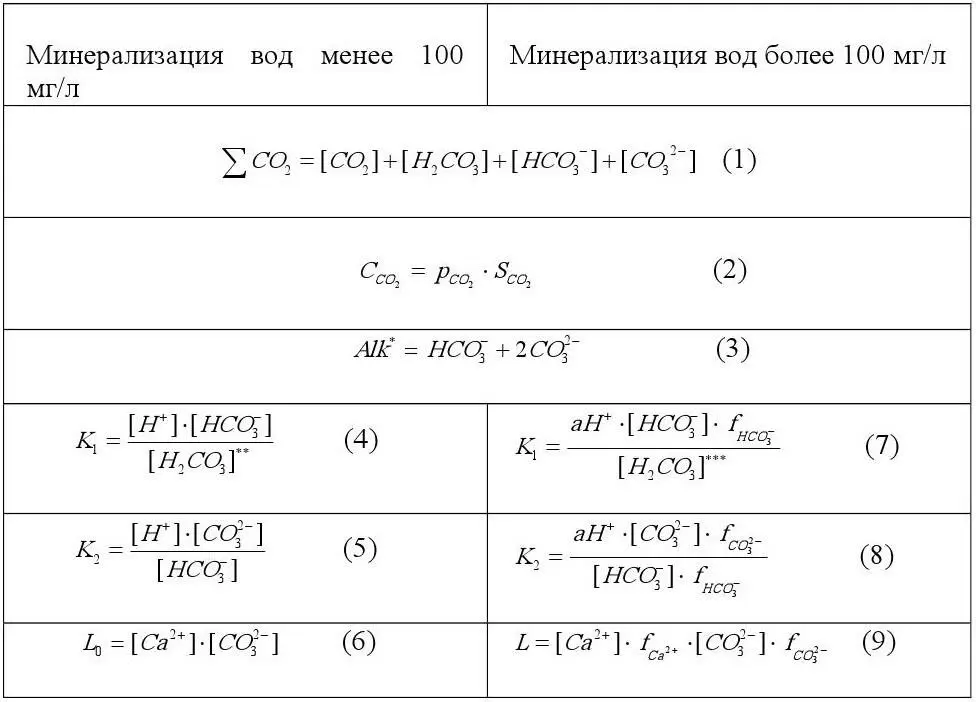
Примечание.
ΣCO 2– общее содержание компонентов карбонатной системы;
C CO2– концентрация свободного диоксида углерода;
P CO2 –парциальное давление СО 2;
S CO2– растворимость СО 2при данной температуре и давлении 10 5Па;
Alk – карбонатная щелочность;
[C i] – концентрация ионов;
[C i]f i– активность ионов;
aH +– активность ионов водорода;
f i– коэффициенты активности ионов;
к 1и к 2– термодинамические константы, соответственно, первой и второй ступени диссоциации угольной кислоты;
L 0– термодинамическое произведение растворимости СаСО 3;
L – произведение активноcти СаСО 3.
* При анализе получают общую щелочность
Однако карбонатная щелочность настолько близка к общей, что в большинстве случаев их не разделяют из-за малой концентрации других составляющих.
** Под концентрацией Н 2СО 3подразумевается общая концентрация растворенного СО 2(СО 2+ Н 2СО 3); тем самым допускается, что растворенный СО 2находится в виде Н 2СО 3.
*** Для недиссоциированной Н 2СО 3коэффициент активности равен единице.
Определение концентрации ионов водорода ( рН )
Величина рН природных вод определяется непосредственно у объекта. В последнее время для определения концентраций водородных ионов на сети станций Госкомгидромета стали применяться электрометрические портативные установки с использованием стеклянного электрода. Однако для работы в полевых условиях все еще основным методом определения рН является колориметрический метод. Из колориметрических методов наиболее надежным является метод с буферными растворами [3]. В значения рН необходимо вносить соответствующие значения солевых и температурных поправок. Наиболее удобной формой выражения величины рН можно считать формулу, предложенную К.Бухом [4]:
Читать дальшеИнтервал:
Закладка:







![Николай Торицын - Краткое руководство по добыче и очистке воды в природных условиях [Учебное пособие]](/books/1149893/nikolaj-toricyn-kratkoe-rukovodstvo-po-dobyche-i-och.webp)


