БСЭ - Большая Советская энциклопедия (ДЕ)
- Название:Большая Советская энциклопедия (ДЕ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ - Большая Советская энциклопедия (ДЕ) краткое содержание
Большая Советская энциклопедия (ДЕ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Действующая длина
Де'йствующая длина'антенны, параметр проволочной антенны, характеризующий её эффективность при передаче и приёме электромагнитных волн. У приёмной антенны Д. д. определяется как отношение эдс на входе приёмника к напряжённости электрического поля, падающего на антенну, а у передающей — как длина находящегося в свободном пространстве провода с равномерным и синфазным распределением тока по всей его длине, создающего в направлении максимума излучения такую же напряжённость поля, что и реальная антенна, при условии равенства амплитуд тока на проводе и в реальной антенне. Д. д. антенны численно одинакова при передаче и приёме.
Действующие армия и флот
Де'йствующие а'рмия и флот,вооружённые силы государства, используемые с началом войны для ведения военных действий (в отличие от остальных вооружённых сил, находящихся в тылу и предназначенных для подготовки резервов, пополнения и снабжения Д. а. и ф.). Личный состав Д. а. и ф. обычно обеспечивается особыми нормами питания, вещевого и денежного довольствия и пользуется преимуществами в исчислении сроков выслуги для присвоения очередных воинских званий и при исчислении пенсий. Наименование «Д. а. и ф.» получило распространение в 19 в. с появлением массовых вооружённых сил, построенных на принципах кадровой армии и кадрового ВМФ.
Действующих масс закон
Де'йствующих масс зако'н,один из основных законов физической химии; устанавливает зависимость скорости химической реакции от концентраций реагирующих веществ и соотношение между концентрациями (или активностями) продуктов реакции и исходных веществ в состоянии химического равновесия. Норвежские учёные К. Гульдберг и П. Вааге, сформулировавшие Д. м. з. в 1864—67, назвали «действующей массой» вещества его количество в единице объёма, т. е. концентрацию, отсюда — наименование закона.
Если в идеальной газовой смеси или идеальном жидком растворе происходит реакция:
а А + а' А' = b B + b' B' (1)
(А, А' и т.д. — вещества, а , а' и т.д. — стехиометрические коэффициенты), то, согласно Д. м. з., скорость реакции в прямом направлении:
r += k +[A] a [A'] a' (2)
Здесь [А] — концентрация вещества А и т.д., k +— константа скорости реакции (в прямом направлении), k +зависит от температуры, а в случае жидкого раствора — также и от давления; последняя зависимость существенна лишь при высоких давлениях. Вид уравнения (2) определяется тем, что необходимым условием элементарного акта реакции является столкновение молекул исходных веществ, т. е. их встреча в некотором малом объёме (порядка размера молекул). Вероятность найти в данный момент в данном малом объёме молекулу А пропорциональна [А]; вероятность найти в нём одновременно а молекул А и а' молекул А' по теореме о вероятности сложного события пропорциональна [А] a [А'] a' . Число столкновений молекул исходных веществ в единичном объёме за единичное время пропорционально этой величине. Определённая доля этих столкновений приводит к реакции. Отсюда вытекает уравнение (2). Мономолекулярные реакции требуют особого рассмотрения.
Скорость реакции (1) в обратном направлении
r - = k - [B] b [B'] b' . (3)
Если реакция обратима, т. е. протекает одновременно в противоположных направлениях, то наблюдаемая скорость реакции r = r +– r -. При r + = r - осуществляется химическое равновесие. Тогда, согласно уравнениям (2) и (3),
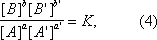
где К = k +/ k -— константа равновесия. Для газовых реакций обычно применяют равноценное уравнение
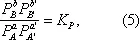
где P A— парциальное давление вещества А и т.д.
Уравнения (2) и (3) применимы к простой (одностадийной) реакции и к отдельным стадиям сложной реакции, но не к сложной реакции в целом. Уравнения (4) и (5), выражающие Д. м. з. для равновесия, справедливы и в случае сложной реакции.
Общим условием равновесия по отношению к реакции (1), приложимость которого не ограничена идеальными системами, является уравнение
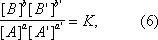
в котором [А] — активность вещества А и т.д. Уравнение (6) выводится из принципов термодинамики. С помощью Д. м. з. для равновесия вычисляют максимально достижимые степени превращения при обратимых реакциях. В число последних входят важные промышленные процессы — синтез аммиака, окисление сернистого газа и многие другие. На основе Д. м. з. для скоростей реакций получают кинетические уравнения, применяемые при расчёте химической аппаратуры.
Лит . см. при ст. Кинетика химическая и Термодинамика химическая .
М. И. Тёмкин.
Дейталлаксы
Дейталла'ксы,дейталлаксисы (от греч. déuteros — второй, последующий и állaxis — обмен), коррелятивные изменения органов животных в результате взаимного приспособления их друг к другу. Термин «Д.» ввёл А. Н. Северцов (1912). См. также Корреляция , Проталлаксы .
Дейтерий
Дейте'рий(лат. Deuterium, от греч. déuteros — второй), D, 2Н, тяжёлый водород, стабильный изотоп водорода с массовым числом 2. Ядро атома Д. — дейтрон . Большое различие в массах D и 1Н обусловливает существенную разницу в их свойствах (например, t kипобычного водорода 20,39 К, t kипД. 23,57 К; скорости некоторых химических реакций различаются для веществ, содержащих D и 1Н, в 5—10 раз). В промышленности Д. выделяют, используя изотопный обмен между водой и сероводородом (Д. неравномерно распределяется между ними, концентрируясь в H 2O), ректификацию жидкого водорода и многоступенчатый электролиз воды (см. Изотопов разделение ). Д. используется во взрывчатой системе для водородной бомбы , в будущем он может стать термоядерным горючим в энергетике. В научных исследованиях Д. применяется как изотопный индикатор . Тяжёлая вода D 2O служит замедлителем нейтронов в атомных реакторах. Д. был открыт спектрально в 1932 американским учёным Г. Юри с сотрудниками.
Лит.: Бродский А. И., Химия изотопов, 2 изд., М., 1957; Киршенбаум И., Тяжелая вода, пер. с англ., М., 1953.
Дейтон
Де'йтон(Dayton), город на С.-В. США, на р. Майами, в штате Огайо. 240 тыс. жителей (1970), с пригородной зоной — 845 тыс. Крупный промышленный центр и транспортный узел. В обрабатывающей промышленности 130 тыс. занятых (1969). Точное машиностроение: производство счётных машин, прецизионных станков, частей и приборов для автомобилей, самолётов и ракет, а также холодильников и др. бытового электрооборудования. Бумажная и резиновая промышленность. Крупный исследовательский центр в области космонавтики — Райт-Паттерсон. Университет. Д. основан в 1796.
Интервал:
Закладка:










