БСЭ - Большая Советская энциклопедия (ТА)
- Название:Большая Советская энциклопедия (ТА)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ - Большая Советская энциклопедия (ТА) краткое содержание
Большая Советская энциклопедия (ТА) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Танта
Та'нта,город в Египте, в дельте Нила, административный центр губернаторства Гарбия. 253,6 тыс. жителей (1970). Узел железных и шоссейных дорог. Предприятия текстильной промышленности. Производство хлопкового масла, молочный завод. Мельница. Кустарно-ремесленные производства.
Тантал (мифологич.)
Танта'л,в древнегреческой мифологии лидийский или фригийский царь, сын Зевса, отец Пелопса и Ниобы . За то, что разгласил тайны олимпийцев, похитил с пира богов нектар и амбросию и, пригласив богов на пир, угостил их блюдом, приготовленным из тела убитого им сына Пелопса, был обречён богами на вечные муки в подземном царстве. Стоя по горло в воде и видя висящие на дереве плоды, Т. не мог утолить жажду и голод, так как вода уходила из-под его губ, а ветвь с плодами отстранялась. Отсюда выражение «танталовы муки».
Тантал (хим. элемент)
Танта'л(латинское Tantalum), Та, химический элемент V группы периодической системы Менделеева; атомный номер 73, атомная масса 180,948; металл серого цвета со слегка свинцовым оттенком. В природе находится в виде двух изотопов: стабильного 181Та(99,99%) и радиоактивного 180Та(0,012%; Т 1/2 = 10 12лет). Из искусственно полученных радиоактивный 182Та( Т 1/2 = 115,1 сут ) используют как радиоактивный индикатор.
Элемент открыт в 1802 шведским химиком А. Г. Экебергом; назван по имени героя древнегреческой мифологии Тантала (из-за трудностей получения Т. в чистом виде). Пластичный металлический Т. впервые получил в 1903 немецкий химик В. Больтон.
Распространение в природе. Среднее содержание Т. в земной коре (кларк)2,5×10 -4% по массе. Характерный элемент гранитной и осадочной оболочек (среднее содержание достигает 3,5×10 -4%); в глубинных частях земной коры и особенно в верхней мантии Т. мало (в ультраосновных породах 1,8×10 -6%) . В большинстве магматических пород и биосфере Т. рассеян; его содержание в гидросфере и организмах не установлено. Известно 17 собственных минералов Т. и более 60 танталсодержащих минералов; все они образовались в связи с магматической деятельностью (танталит, колумбит, лопарит, пирохлор и др.). В минералах Т. находится совместно с ниобием вследствие сходства их физических и химических свойств (см. Танталовые руды и Ниобиевые руды ) . Руды Т. известны в пегматитах гранитных и щелочных пород, карбонатитах , в гидротермальных жилах, а также в россыпях, которые имеют наибольшее практическое значение.
Физические и химические свойства. Т. имеет кубическую объёмно-центрированную решётку ( а = 3,296 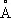 ); атомный радиус 1,46
); атомный радиус 1,46 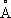 , ионные радиусы Та 2+0,88 А, Та 5+0,66 А; плотность 16,6 г/см 3при 20 °С; t пл2996 °С; t кип5300 °С; удельная теплоёмкость при 0—100 °С 0,142 кдж/ ( кг× К) [0,034 кал/ ( г × °С)]; теплопроводность при 20—100 °С 54,47 вт/ ( м×К ) [0,13 кал/ ( см × сек ×°С)]. Температурный коэффициент линейного расширения 8,0×10 -6(20—1500 °С); удельное электросопротивление при 0°С 13,2×10 -8 ом×м, при 2000 °С 87×10 -8 ом×м. При 4,38 К становится сверхпроводником. Т. парамагнитен, удельная магнитная восприимчивость 0,849×10 -6(18 °С). Чистый Т. — пластичный металл, обрабатывается давлением на холоду без значительного наклёпа. Его можно деформировать со степенью обжатия 99% без промежуточного отжига. Переход Т. из пластичного в хрупкое состояние при охлаждении до -196 °С не обнаружен. Модуль упругости Т. 190 Гн/м 2(190×10 2 кгс/мм 2) при 25 °С. Предел прочности при растяжении отожжённого Т. высокой чистоты 206 Мн/м 2(20,6 кгс/мм 2) при 27 °С и 190 Мн/м 2(19 кгс/мм 2) при 490 °С; относительное удлинение 36% (27 °С) и 20% (490 °С). Твёрдость по Бринеллю чистого рекристаллизованного Т. 500 Мн/м 2(50 кгс/мм 2) . Свойства Т. в большой степени зависят от его чистоты; примеси водорода, азота, кислорода и углерода делают металл хрупким.
, ионные радиусы Та 2+0,88 А, Та 5+0,66 А; плотность 16,6 г/см 3при 20 °С; t пл2996 °С; t кип5300 °С; удельная теплоёмкость при 0—100 °С 0,142 кдж/ ( кг× К) [0,034 кал/ ( г × °С)]; теплопроводность при 20—100 °С 54,47 вт/ ( м×К ) [0,13 кал/ ( см × сек ×°С)]. Температурный коэффициент линейного расширения 8,0×10 -6(20—1500 °С); удельное электросопротивление при 0°С 13,2×10 -8 ом×м, при 2000 °С 87×10 -8 ом×м. При 4,38 К становится сверхпроводником. Т. парамагнитен, удельная магнитная восприимчивость 0,849×10 -6(18 °С). Чистый Т. — пластичный металл, обрабатывается давлением на холоду без значительного наклёпа. Его можно деформировать со степенью обжатия 99% без промежуточного отжига. Переход Т. из пластичного в хрупкое состояние при охлаждении до -196 °С не обнаружен. Модуль упругости Т. 190 Гн/м 2(190×10 2 кгс/мм 2) при 25 °С. Предел прочности при растяжении отожжённого Т. высокой чистоты 206 Мн/м 2(20,6 кгс/мм 2) при 27 °С и 190 Мн/м 2(19 кгс/мм 2) при 490 °С; относительное удлинение 36% (27 °С) и 20% (490 °С). Твёрдость по Бринеллю чистого рекристаллизованного Т. 500 Мн/м 2(50 кгс/мм 2) . Свойства Т. в большой степени зависят от его чистоты; примеси водорода, азота, кислорода и углерода делают металл хрупким.
Конфигурация внешних электронов атома Та 5d 3 6s 2 . Наиболее характерная степень окисления Т. + 5; известны соединения с низшей степенью окисления (например, TaCl 4, ТaCl з, TaCl 2), однако их образование для Т. менее характерно, чем для ниобия.
В химическом отношении Т. при обычных условиях малоактивен (сходен с ниобием). На воздухе чистый компактный Т. устойчив; окисляться начинает при 280 °С. Имеет лишь один стабильный окисел — пятиокись Ta 2O 5, которая существует в двух модификациях: a-форме белого цвета ниже 1320 °С и b-форме серого цвета выше 1320 °С; имеет кислотный характер. С водородом при температуре около 250 °С Т. образует твёрдый раствор, содержащий до 20 атомных % водорода при 20 °С; при этом Т. становится хрупким; при 800—1200 °С в высоком вакууме водород выделяется из металла и его пластичность восстанавливается. С азотом при температуре около 300 °С образует твёрдый раствор и нитриды Ta 2N и TaN; в глубоком вакууме выше 2200 °С поглощённый азот вновь выделяется из металла. В системе Та — С при температуре до 2800 °С установлено существование трёх фаз: твёрдого раствора углерода в Т., низшего карбида Т 2С и высшего карбида TaC. Т. реагирует с галогенами при температуре выше 250 °С (с фтором при комнатной температуре), образуя галогениды преимущественно типа TaX 5(где Х = F, Cl, Вг, I), При нагревании Та взаимодействует с С, В, Si, Р, Se, Те, водой, CO, CO 2, NO, HCI, H 2S.
Чистый Т. исключительно устойчив к действию многих жидких металлов: Na, К и их сплавов, Li, Pb и др., а также сплавов U — Mg и Pu — Mg. Т. характеризуется чрезвычайно высокой коррозионной устойчивостью к действию большинства неорганических и органических кислот: азотной, соляной, серной, хлорной и др., царской водки, а также многих др. агрессивных сред. Действуют на Т. фтор, фтористый водород, плавиковая кислота и её смесь с азотной кислотой, растворы и расплавы щелочей. Известны соли танталовых кислот — танталаты общей формулы x Me 2O× у Та 2О 5×Н 2О: метатанталаты MeTaO 3, ортотанталаты Me 3TaO 4, соли типа Me 5TaO 5, где Me — щелочной металл; в присутствии перекиси водорода образуются также пертанталаты. Наиболее важны танталаты щелочных металлов — KTaO 3и NaTaO 3; эти соли — сегнетоэлектрики.
Получение. Руды, содержащие Т., редки, комплексны, бедны Т.; перерабатывают руды, содержащие до сотых долей процента (Та, Nb) 2O 5, и шлаки восстановительной плавки оловянных концентратов. Основным сырьём для производства Т., его сплавов и соединений служат танталитовые и лопаритовые концентраты, содержащие соответственно около 8% Ta 2O 5и 60% и более Nb 2O 5. Концентраты перерабатывают обычно в три стадии: 1) вскрытие, 2) разделение Та и Nb и получение их чистых соединений, 3) восстановление и рафинирование Та. Танталитовые концентраты разлагают кислотами или щелочами, лопаритовые — хлорируют. Разделяют Та и Nb с получением чистых соединений экстракцией, например трибутилфосфатом из плавиково-кислых растворов, или ректификацией хлоридов.
Читать дальшеИнтервал:
Закладка:










