БСЭ - Большая Советская энциклопедия (Бо)
- Название:Большая Советская энциклопедия (Бо)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ - Большая Советская энциклопедия (Бо) краткое содержание
Большая Советская энциклопедия (Бо) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
В книге «Химик-скептик» (вышедшей в 1661 анонимно) Б. доказывает, что химия должна стать самостоятельной наукой, а не заниматься попытками превращения неблагородных металлов в золото (см. Алхимия ) , а также поисками способов приготовления лекарств (см. Ятрохимия ) . Он отвергает и учение о четырёх стихиях (огне, воздухе, воде и земле), и учение Парацельса о трёх началах (сере, ртути и соли), из которых якобы состоят все природные тела. Элементами Б. считал простые тела, которые не могут быть приготовлены из других тел.
В своих экспериментальных исследованиях Б. широко применял и качественные, и количественные методы. Так, исследуя состав минеральных вод (1684—85), он пользовался отваром чернильных орешков для открытия железа, аммиаком для открытия меди, растительными красками для установления кислой или щелочной реакции, отмечал вкус вод и измерял их плотность. Описывая свойства фосфора (полученного Б. в 1680 независимо от других химиков), Б. указывал его цвет, запах, плотность, способность светиться, его отношение к растворителям. Б. часто пользовался весами, хотя и небольшой точности (от 1 до 0,5 грана, т. е. от 60 до 30 мг ) . Особенно известны его опыты обжигания металлов в запаянных сосудах (опубликованы в 1673). Б. взвешивал реторты с металлом до обжигания; после обжигания он вновь производил взвешивание, предварительно отломав запаянную шейку. При этом всегда наблюдался привес, который Б. ошибочно объяснил тем, что «корпускулы огня» проникают сквозь стекло и поглощаются металлом. В 1756 М. В. Ломоносов показал, что вес сосуда, в котором запаян металл, не изменяется после обжигания, остаётся постоянным. В 1774 А. Л. Лавуазье подтвердил этот вывод и сверх того доказал, что металлы при обжигании соединяются с кислородом воздуха и поэтому происходит увеличение веса.
Работы Б. дали Энгельсу повод сказать: «Бойль делает из химии науку» («Диалектика природы», 1969, с. 158). Б. только начал преобразование химии в науку. Этот процесс завершился во 2-й половине 18 — начале 19 вв. благодаря трудам Ломоносова, Лавуазье и Дальтона. Тем не менее исторические заслуги Б., который сформулировал первое научное определение понятия химического элемента, ввёл в химию экспериментальный метод, положил начало химическому анализу мокрым путём и признал химию самостоятельной наукой, совершенно несомненны.
Б. принадлежат фундаментальные работы по физике. В 1662 Б. совместно с Р. Тоунлеем установил зависимость объёма одной и той же массы воздуха от давления при неизменной температуре (см. Бойля — Мариотта закон ).
Мировоззрение Б. сложно и противоречиво. Будучи сторонником атомизма П. Гассенди, опиравшегося на учение Эпикура, Б., однако, боялся подорвать этим учением догматы религии. Отстаивая принципы механицизма, он отрицал объективное существование качественных различий и сводил всё многообразие явлений к различиям в числе, пространственной группировке и к механическому движению первичных бескачественных корпускул (атомов), различающихся лишь размером и формой. В объяснении свойства вещей Б. опирался на выдвинутую Дж. Локком концепцию первичных и вторичных качеств. Своё механистическое мировоззрение Б. изложил в сочинении «Происхождение форм и качеств согласно корпускулярной философии» (1666). Обнаруживая непоследовательность механистического материализма, его неспособность найти в самой материи источник всех её изменений природы, Б. пытался найти выход в религиозном мировоззрении.
Соч.: The works, epitomiz'd by Boulton, v. 1—3, L., 1699—1700: The works, ed. by Thomas Birch, v. 1-6, 2 ed., L., 1772; The sceptical chemist, L. — N.Y., [1949].
Лит.: Джуа М., История химии, пер. с итал., М., 1966, с. 87—94; Фигуровский Н. А., Очерки общей истории химии от древнейших времен до начала 19 в., М., 1969; More L. Т., The life and works of the honourable Robert Boyle, L. — [a. o.], 1944; Boas М., Robert Boyle and the seventeenth century chemistry, Camb., 1958; Partington J. F..., A history of chemistry, v. 2, L., 1961, p. 486-549; Fulton J. F., A bibliography of the honourable R. Boyle, Oxf., 1961.
С. А. Погодин.

Р. Бойль.
Бойля - Мариотта закон
Бо'йля — Марио'тта зако'н,один из основных газовых законов, согласно которому при постоянной температуре объём V данной массы идеального газа обратно пропорционален его давлению р, т. е. pV = C = const ( рис. 1 ). Постоянная С пропорциональна массе газа (числу молей ) и его абсолютной температуре .
Закон установлен по опытным данным английским учёным Р. Бойлем (1662) и независимо от него французским учёным Э. Мариоттом (1676).
Б. — М. з. следует из кинетической теории газов, если принять, что размеры молекул пренебрежимо малы по сравнению с расстоянием между ними и отсутствует межмолекулярное взаимодействие . Иными словами, Б. — М. з. выполняется строго для идеального газа . Для реальных газов, у которых влиянием размеров молекул и их взаимодействием пренебрегать нельзя, Б. — М. з. выполняется приближённо ( рис. 2 ), тем лучше, чем дальше от критического состояния находится газ.
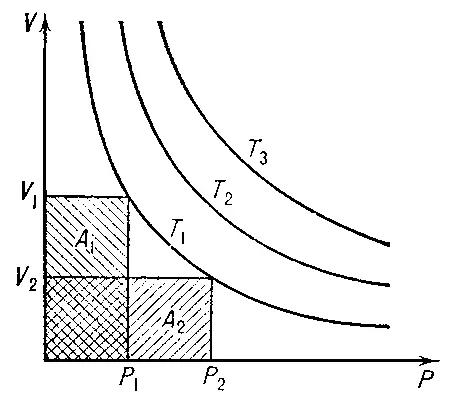
Рис. 1. Зависимость объёма V неизменной массы идеального газа от давления р при постоянной температуре Т. Изотермы T 1, T 2, T 3имеют вид равносторонних гипербол, площади А 1и A 2равны постоянной С.
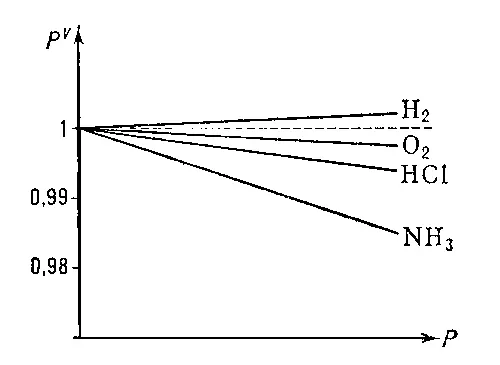
Рис. 2. Отклонение поведения реальных газов от закона Бойля — Мариотта. Пунктир соответствует линии pV=C.
Бойля точка
Бо'йля то'чка,точка минимума на изотерме реального газа, изображенной в координатах р — pV (см. рис ., р — давление газа, V — занимаемый газом объём); названа по имени английского учёного Р. Бойля .
Вблизи Б. т. небольшие участки изотерм реального газа можно приближённо рассматривать как отрезки горизонтальных прямых, представляющих, согласно Клапейрона уравнению pV = mRT, изотермы идеального газа ( Т — абсолютная температура, R — газовая постоянная, т — масса газа). Иными словами, Б. т. определяет температуру, при которой для данного реального газа применимо уравнение идеального газа. Участок изотермы аЬ (слева от Б. т.) соответствует условиям, когда реальный газ более сжимаем, чем идеальный; участок bc (справа от Б. т.) соответствует условиям меньшей сжимаемости реального газа по сравнению с идеальным. Слева от Б. т. сказывается преобладающее влияние сил притяжения между молекулами, облегчающих сжатие газа, справа от Б. т. — влияние собственного объёма молекул, препятствующего сжатию. Вблизи Б. т. эти факторы, отличающие реальный газ от идеального, взаимно компенсируются.
Читать дальшеИнтервал:
Закладка:










