БСЭ - Большая Советская энциклопедия (ГЕ)
- Название:Большая Советская энциклопедия (ГЕ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ - Большая Советская энциклопедия (ГЕ) краткое содержание
Большая Советская энциклопедия (ГЕ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
А. Д. Вартаньянц.
Герман Яков
Ге'рманЯков (16.7.1678, Базель, — 14.7.1733, там же), первый академик-математик Петербургской АН (1725). Швейцарец по происхождению. Ученик Я. Бернулли . Широко применял полярные координаты, разрабатывал аналитическую геометрию в пространстве, изучил кривые на шаровой поверхности, первый в России занимался историей математики.
Лит.: Юшкевич А. П., История математики в России до 1917 года, М., 1968.
Германарих
Германа'рих(Hermanarich), предводитель племенного союза, возглавленного остготами (4 в.); см. Эрманарих .
Германиды
Германи'ды, соединения германия с металлами. Составы большинства Г. аналогичны соответствующим силицидам и не подчиняются правилам формальной валентности (KGe, KGe 4, BaGe 2, Mn 5Ge 3, UGe 3и др.). Г. щелочных, щёлочноземельных металлов и магния легко разлагаются водой и кислотами с образованием германоводородов; большинство Г. переходных металлов к действию кислот и щелочей устойчиво. Основной способ получения Г. — сплавление или спекание компонентов. Г. щелочных и щёлочноземельных металлов — полупроводники, а Г. переходных металлов обладают металлическими свойствами. Большой интерес представляют Г. ниобия и ванадия и сплавы на их основе, имеющие сравнительно высокие температуры перехода в сверхпроводящее состояние (Nb 3Ge 6,3°К; Nb 3Sn 1—xGe x17,6—18°К; V 3Ge 6,01°К). Г. перспективны для создания новых сплавов с особыми физическими свойствами.
Лит.: Самсонов Г. В., Бондарев В. Н., Германиды, М., 1968.
Б. А. Поповкин.
Германизмы
Германи'змы, слова и выражения русского языка, заимствованные из немецкого языка. До эпохи Петра I в русский язык вошли такие слова, как «стул», «шляпа» (16 в.), «ярмарка», «ротмистр» (17 в.). В 1-й половине 18 в. интенсивное прямое заимствование из немецкого языка происходит в области административной терминологии — «ранг», «штраф», «канцлер», «бухгалтер»; военного дела — «юнкер», «лагерь», «гауптвахта»; искусств, ремёсел. Во 2-й половине 18 в. русский язык усваивает из немецкого также ряд синтаксических и словообразовательных ка'лек (сравнить «выглядеть» с немецким aussehen). В середине 19 в. наблюдается приток политических и философских терминов, особенно в виде ка'лек (ср. Weltanschauung — «мировоззрение», Selbstbestimmung — «самоопределение»).
Лит.: Богородицкий В. А., Общий курс русской грамматики, 5 изд., М. — Л., 1935, гл. 17; Виноградов В. В., Очерки по истории русского литературного языка XVII—XIX вв., 2 изд., М., 1938; Булаховский Л. А., Курс русского литературного языка, т. 2, 4 изд.. К., 1953.
Германий
Герма'ний(лат. Germanium), Ge, химический элемент IV группы периодической системы Менделеева; порядковый номер 32, атомная масса 72,59; твёрдое вещество серо-белого цвета с металлическим блеском. Природный Г. представляет собой смесь пяти стабильных изотопов с массовыми числами 70, 72, 73, 74 и 76. Существование и свойства Г. предсказал в 1871 Д. И. Менделеев и назвал этот неизвестный еще элемент «экасилицием» из-за близости свойств его с кремнием. В 1886 немецкий химик К. Винклер обнаружил в минерале аргиродите новый элемент, который назвал Г. в честь своей страны; Г. оказался вполне тождествен «экасилицию». До 2-й половины 20 в. практическое применение Г. оставалось весьма ограниченным. Промышленное производство Г. возникло в связи с развитием полупроводниковой электроники.
Общее содержание Г. в земной коре 7 .10 —4% по массе, т. е. больше, чем, например, сурьмы, серебра, висмута. Однако собственные минералы Г. встречаются исключительно редко. Почти все они представляют собой сульфосоли: германит Cu 2(Cu, Fe, Ge, Zn) 2(S, As) 4, аргиродит Ag 8GeS 6, конфильдит Ag 8(Sn, Ce) S 6и др. Основная масса Г. рассеяна в земной коре в большом числе горных пород и минералов: в сульфидных рудах цветных металлов, в железных рудах, в некоторых окисных минералах (хромите, магнетите, рутиле и др.), в гранитах, диабазах и базальтах. Кроме того, Г. присутствует почти во всех силикатах, в некоторых месторождениях каменного угля и нефти.
Физические и химические свойства. Г. кристаллизуется в кубической структуре типа алмаза, параметр элементарной ячейки а = 5, 6575 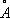 . Плотность твёрдого Г. 5,327 г/см 3 (25°С); жидкого 5,557 (1000°С); t пл 937,5°С; t kип около 2700°С; коэффициент теплопроводности ~60 вт/ ( м ( К ), или 0,14 кал/ ( см ( сек ( град ) при 25°С. Даже весьма чистый Г. хрупок при обычной температуре, но выше 550°С поддаётся пластической деформации. Твёрдость Г. по минералогической шкале 6—6,5; коэффициент сжимаемости (в интервале давлений 0—120 Гн/м 2 или 0—12000 кгс/мм 2 ) 1,4·10 —7 м 2/мн (1,4·10 —6 см 2/кгс ); поверхностное натяжение 0,6 н/м (600 дин/см ). Г. — типичный полупроводник с шириной запрещенной зоны 1,104·10 —19, или 0,69 эв (25°С); удельное электросопротивление Г. высокой чистоты 0,60 ом ( м (60 ом ( см ) при 25°С; подвижность электронов 3900 и подвижность дырок 1900 см 2/в .сек (25°С) (при содержании примесей менее 10 —8%). Прозрачен для инфракрасных лучей с длиной волны больше 2 мкм .
. Плотность твёрдого Г. 5,327 г/см 3 (25°С); жидкого 5,557 (1000°С); t пл 937,5°С; t kип около 2700°С; коэффициент теплопроводности ~60 вт/ ( м ( К ), или 0,14 кал/ ( см ( сек ( град ) при 25°С. Даже весьма чистый Г. хрупок при обычной температуре, но выше 550°С поддаётся пластической деформации. Твёрдость Г. по минералогической шкале 6—6,5; коэффициент сжимаемости (в интервале давлений 0—120 Гн/м 2 или 0—12000 кгс/мм 2 ) 1,4·10 —7 м 2/мн (1,4·10 —6 см 2/кгс ); поверхностное натяжение 0,6 н/м (600 дин/см ). Г. — типичный полупроводник с шириной запрещенной зоны 1,104·10 —19, или 0,69 эв (25°С); удельное электросопротивление Г. высокой чистоты 0,60 ом ( м (60 ом ( см ) при 25°С; подвижность электронов 3900 и подвижность дырок 1900 см 2/в .сек (25°С) (при содержании примесей менее 10 —8%). Прозрачен для инфракрасных лучей с длиной волны больше 2 мкм .
В химических соединениях Г. обычно проявляет валентности 2 и 4, причём более стабильны соединения 4-валентного Г. При комнатной температуре Г. устойчив к действию воздуха, воды, растворам щелочей и разбавленных соляной и серной кислот, но легко растворяется в царской водке и в щелочном растворе перекиси водорода. Азотной кислотой медленно окисляется. При нагревании на воздухе до 500—700°С Г. окисляется до окиси GeO и двуокиси GeO 2. Двуокись Г. — белый порошок с t пл 1116°С; растворимость в воде 4,3 г/л (20°С). По химическим свойствам амфотерна, растворяется в щелочах и с трудом в минеральных кислотах. Получается прокаливанием гидратного осадка (GeO 2 . n H 2O), выделяемого при гидролизе тетрахлорида GeCl 4. Сплавлением GeO 2с др. окислами могут быть получены производные германиевой кислоты — германаты металлов (In 2CeO 3, Na 2Ge О 3и др.) — твёрдые вещества с высокими температурами плавления.
При взаимодействии Г. с галогенами образуются соответствующие тетрагалогениды. Наиболее легко реакция протекает с фтором и хлором (уже при комнатной температуре), затем с бромом (слабое нагревание) и с иодом (при 700—800°С в присутствии CO). Одно из наиболее важных соединений Г. тетрахлорид GeCl 4— бесцветная жидкость; t пл —49,5°С; t kип 83,1°С; плотность 1,84 г/см 3 (20°С). Водой сильно гидролизуется с выделением осадка гидратированной двуокиси. Получается хлорированием металлического Г. или взаимодействием GeO 2с концентрированной НС1. Известны также дигалогениды Г. общей формулы GeX 2, монохлорид GeCl, гексахлордигерман Ge 2Cl 6и оксихлориды Г. (например, GeOCl 2).
Читать дальшеИнтервал:
Закладка:










