БСЭ - Большая Советская энциклопедия (ВА)
- Название:Большая Советская энциклопедия (ВА)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ - Большая Советская энциклопедия (ВА) краткое содержание
Большая Советская энциклопедия (ВА) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Лит.: Gabory E., La révolution et la Vendée d'aprés les documents inédits, t. I—3, P., 1925—28; Dubreuil L., Histoire des insurrections de l'Ouest, t. 1—2, P., 1929—30; Faucheux M., L'insurrection vendéenne de 1793, P., 1964: Tilly Ch.. The Vendée, L., 1964; Mazauric C., Vendée et chouannerié, «La Pensee», 1965, № 124.
А. В. Гордон.
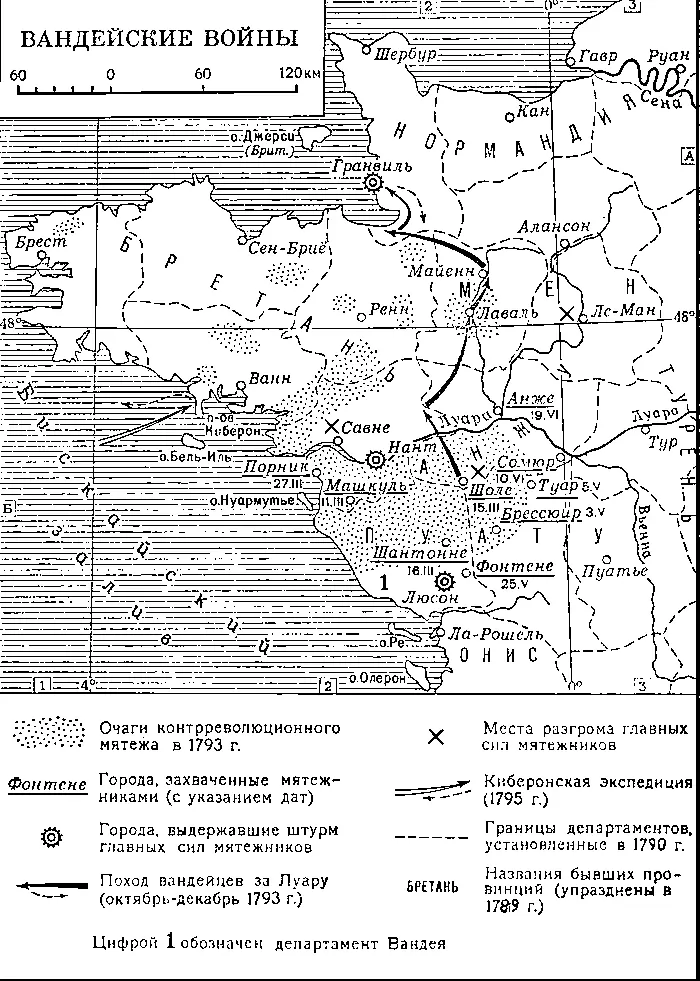
Вандейские войны.
«Вандель-Сиделор»
«Ванде'ль-Сидело'р»(франц.), см. Монополии в чёрной металлургии .
Вандемьер
Вандемье'р(франц. vendémiaire, от лат. vindemia — сбор винограда), первый месяц года по французскому республиканскому календарю, введённому в октябре 1793 и действовавшему до 1 января 1806. Соответствовал 22—23 сентября — 21—22 октября.
Вандемьерский мятеж
Вандемье'рский мяте'ж,вооружённое выступление роялистов в Париже 3—5 октября (11—13 вандемьера) 1795. Активизировавшиеся после контрреволюционного термидорианского переворота (июль 1794) роялисты стремились к восстановлению монархии во Франции. Поводом к В. м. послужило принятие 22 августа 1795 термидорианским Конвентом Французской конституции III года, лишившей монархистов возможности получить преобладание в законодательных органах. Сосредоточив в Париже значительное количество скрытых монархистов, роялисты 3 октября 1795 окружили здание Конвента и создали серьёзную опасность для термидорианского правительства. П. Баррас , назначенный командующим правительств. силами, передал руководство военными операциями генералу Наполеону Бонапарту, который, применив пушки, 5 октября 1795 ликвидировал роялистский мятеж.
Лит.: Вандаль А., Возвышение Бонапарта. Происхождение брюмерского консульства. Конституция III года, пер. с франц., СПБ, 1905.
Вандер Карл Фридрих Вильгельм
Ва'ндер(Wander) Карл Фридрих Вильгельм (27.12.1803, Фишбах, Силезия, — 4.6.1879, Квирль, там же), немецкий педагог-демократ, последователь И. Г. Песталоцци и соратник А. Дистервега . Выступая против конфессиональной разобщённости школьного дела, защищал идею создания единой демократической школы. Сыграл большую роль в создании локальных объединений учительства (особенно в Силёзии) и в организации общенемецкого учительского союза. В период Революции 1848—49 находился на стороне демократических сил. За свою деятельность подвергался полицейским преследованиям, в 1850 отстранён от государственной службы.
В. — автор многочисленных статей на общественно-политические и педагогические темы. Отстаивал необходимость воспитания детей в духе гуманизма, подготовки физически и духовно развитых полезных членов общества. Автор многих учебников и методических пособий, а также научных работ по филологии. Его «Словарь немецких пословиц и поговорок» (1867—80; 5 тт.) сохранил ценность до настоящего времени. К 150-летию со дня рождения В. в ГДР была учреждена в его честь медаль, которой были награждены работники народного образования, достигшие выдающихся успехов в борьбе за демократизацию немецкой школы.
Лит.: К. F. W. Wander, 1803 bis 1879, В. 1954.
А. И. Пискунов.
Вандербейлпарк
Ва'ндербейлпарк,город в ЮАР; см. Фандербейлпарк .
Ван-дер-Ваальс Ян Дидерик
Ван-дер-Ва'альсЯн Дидерик, голландский физик; см. Ваальс Я. Д. ван дер.
Ван-дер-Ваальса уравнение
Ван-дер-Ва'альса уравне'ние,одно из первых уравнений состояния реального газа, предложенное голландским физиком Я. Д. Ван-дер-Ваальсом (1873):
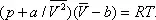
Здесь: р — давление газа; Т — его температура; 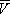 — объём одного моля вещества; R — универсальная газовая постоянная ; а и b — константы, учитывающие отклонение свойств реального газа от свойств идеального. Член
— объём одного моля вещества; R — универсальная газовая постоянная ; а и b — константы, учитывающие отклонение свойств реального газа от свойств идеального. Член 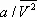 , имеющий размерность давления, учитывает притяжение между молекулами газа за счёт ван-дер-ваальсовых сил (см. Межмолекулярное взаимодействие ). Константа b является поправкой на собственный объём молекул газа и учитывает отталкивание молекул на близких расстояниях. Константы а и b обычно определяются из экспериментальных данных. При больших
, имеющий размерность давления, учитывает притяжение между молекулами газа за счёт ван-дер-ваальсовых сил (см. Межмолекулярное взаимодействие ). Константа b является поправкой на собственный объём молекул газа и учитывает отталкивание молекул на близких расстояниях. Константы а и b обычно определяются из экспериментальных данных. При больших 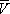 можно пренебречь обеими поправками и В. у. переходит в уравнение состояния идеального газа (см. Клапейрона уравнение ).
можно пренебречь обеими поправками и В. у. переходит в уравнение состояния идеального газа (см. Клапейрона уравнение ).
В. у. является приближённым и количественно описывает свойства реальных газов лишь в области высоких температур и низких давлений. Однако качественно оно позволяет описывать поведение газа при высоких давлениях, конденсацию газа в жидкость и критическое состояние (см. также Уравнение состояния ).
На рис. изображено семейство изотерм (кривых зависимости р от 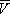 при постоянной температуре), рассчитанных по В. у. Это уравнение, кубическое относительно
при постоянной температуре), рассчитанных по В. у. Это уравнение, кубическое относительно 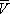 , имеет три корня. При низких температурах все три корня — действительные, а выше определённой температуры Тк , называемой критической, остаётся лишь один действительный корень. Физически это означает, что при Т > Т к вещество может находиться лишь в одном (газообразном) состоянии, а ниже Т к — в трёх состояниях (двух стабильных — жидком
, имеет три корня. При низких температурах все три корня — действительные, а выше определённой температуры Тк , называемой критической, остаётся лишь один действительный корень. Физически это означает, что при Т > Т к вещество может находиться лишь в одном (газообразном) состоянии, а ниже Т к — в трёх состояниях (двух стабильных — жидком 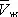 и газообразном
и газообразном 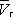 — и одном нестабильном). Графически это выражается так: при Т < Т к изотерма имеет три точки пересечения с прямой ac , параллельной оси объёмов. Точки прямой ac отвечают равновесию жидкости и её насыщенного пара. В условиях равновесия, например в состоянии, соответствующем точке b , относительные количества жидкости и пара определяются отношением отрезков bc / ba («правило моментов»). Равновесию фаз при определённой температуре соответствуют давление насыщенного пара р нп и интервал объёмов от
— и одном нестабильном). Графически это выражается так: при Т < Т к изотерма имеет три точки пересечения с прямой ac , параллельной оси объёмов. Точки прямой ac отвечают равновесию жидкости и её насыщенного пара. В условиях равновесия, например в состоянии, соответствующем точке b , относительные количества жидкости и пара определяются отношением отрезков bc / ba («правило моментов»). Равновесию фаз при определённой температуре соответствуют давление насыщенного пара р нп и интервал объёмов от 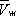 до
до 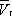 . При более низких давлениях (правее
. При более низких давлениях (правее 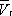 ) изотерма характеризует свойства газа. Левая, почти вертикальная часть изотермы отражает очень малую сжимаемость жидкости. Участки ad и ес относятся соответственно к перегретой жидкости и переохлажденному пару ( метастабильные состояния ). Участок de физически неосуществим, так как здесь происходит увеличение объёма при увеличении давления. Совокупность точек а , a' , а» ... и с , c' , с» ... определяет кривую, называемую бинодалью, которая очерчивает область совместного существования газа и жидкости. В критической точке К температура, давление и объём ( Тк , р к ,
) изотерма характеризует свойства газа. Левая, почти вертикальная часть изотермы отражает очень малую сжимаемость жидкости. Участки ad и ес относятся соответственно к перегретой жидкости и переохлажденному пару ( метастабильные состояния ). Участок de физически неосуществим, так как здесь происходит увеличение объёма при увеличении давления. Совокупность точек а , a' , а» ... и с , c' , с» ... определяет кривую, называемую бинодалью, которая очерчивает область совместного существования газа и жидкости. В критической точке К температура, давление и объём ( Тк , р к , 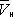 ) имеют значения, характерные для каждого вещества. Однако, если в В. у. ввести относительные величины: Т/Т к , Р/р к и
) имеют значения, характерные для каждого вещества. Однако, если в В. у. ввести относительные величины: Т/Т к , Р/р к и 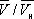 , то можно получить так называемое приведённое В. у., которое является универсальным, то есть не зависит от индивидуальных свойств вещества.
, то можно получить так называемое приведённое В. у., которое является универсальным, то есть не зависит от индивидуальных свойств вещества.
Интервал:
Закладка:










