БСЭ БСЭ - Большая Советская Энциклопедия (АД)
- Название:Большая Советская Энциклопедия (АД)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (АД) краткое содержание
Большая Советская Энциклопедия (АД) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Адсорбция
Адсо'рбция(от лат. ad — на, при и sorbeo — поглощаю), поглощение к.-л. вещества из газообразной среды или раствора поверхностным слоем жидкости или твёрдого тела. Например, если поместить в водный раствор уксусной кислоты кусочек угля, то произойдёт А. — количество кислоты в растворе уменьшится, молекулы кислоты сконцентрируются на поверхности угля. А. и абсорбция— поглощение в объёме тела, объединяются общим термином сорбция. Явление А. стало изучаться со 2-й половины 18 в. ( Шееле, 1773), хотя несомненно, что в практической деятельности человечества А. использовалась с незапамятных времён. Учение об А. является частью более общей теории многокомпонентных гетерогенных систем, основы которой заложены У. Гиббсом (1876). Явление А. тесно связано с особыми свойствами вещества в поверхностном слое. например, молекулы, лежащие на поверхности раздела фаз жидкость — пар, втягиваются внутрь жидкости, т. к. испытывают большее притяжение со стороны молекул, находящихся в объёме жидкости, чем со стороны молекул пара, концентрация которых во много раз меньше концентрации жидкости. Это внутреннее притяжение заставляет поверхность сокращаться и количественно характеризуется поверхностным натяжением. По той же причине молекулы какого-либо другого вещества, оказавшиеся вблизи поверхности, притянутся к ней и произойдёт А. После А. внутреннее притяжение частично компенсируется притяжением со стороны адсорбционного слоя и поверхностное натяжение уменьшается. Гиббс вывел формулу, связывающую значение А. с изменением поверхностного натяжения. Те вещества, А. которых сильно уменьшает поверхностное натяжение, принято называть поверхностно-активными.
Вещество, на поверхности которого происходит А., называется адсорбентом, а поглощаемое из объёмной фазы — адсорбатом. В зависимости от характера взаимодействия между молекулой адсорбата и адсорбентом А. принято подразделять на физическую А. и хемосорбцию. Менее прочная физическая А. не сопровождается существенными изменениями молекул адсорбата. Она обусловлена силами межмолекулярного взаимодействия, которые связывают молекулы в жидкостях и некоторых кристаллах и проявляются в поведении сильно сжатых газов. При хемосорбции молекулы адсорбата и адсорбента образуют химические соединения. Часто А. обусловлена и физическими и химическими силами, поэтому не существует чёткой границы между физикой А. и хемосорбцией.
Физически адсорбированные молекулы более или менее свободно перемещаются по поверхности, при этом их свойства часто аналогичны свойствам очень тонкого слоя газа, т. н. двухмерного газа. Они могут собираться группами, образуя слой двухмерной жидкости или двухмерного твёрдого тела. Адсорбированные молекулы рано или поздно покидают поверхность — десорбируются. Время, в течение которого молекула находится на поверхности, называется временем А. Времена А. могут колебаться в очень широких пределах. Скоростью А. (соответственно скоростью десорбции) называется количество молекул, адсорбирующихся (или десорбирующихся) за единицу времени, оба значения величин относят к единице поверхности или массы адсорбента. Скорость хемосорбции, как и скорость любого химического процесса, чаще всего увеличивается с повышением температуры (т. н. активированная А., см. Хемосорбция ) . Если скорости А. и десорбции равны друг другу, то говорят, что установилось адсорбционное равновесие. В состоянии равновесия количество адсорбированных молекул остаётся постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и др.).
Адсорбированные молекулы не только совершают движение вдоль поверхности адсорбента, но и колеблются, то приближаясь к поверхности, то удаляясь от неё. Чем выше температура, тем интенсивнее колебательное движение, а стало быть, больше вероятность того, что в процессе таких колебаний связь молекулы с поверхностью будет разорвана и молекула десорбируется. Благодаря этому с ростом температуры уменьшается время А. и равновесное количество адсорбированных молекул.
С ростом концентрации или давления адсорбата в объёме увеличивается частота попаданий молекул адсорбата на поверхность адсорбента; пропорционально ей возрастает скорость А. и увеличивается равновесное количество адсорбированных молекул. Кривые зависимости равновесной А. от концентрации или давления адсорбата при постоянной температуре называются изотермами А.
Если адсорбат покрывает поверхность слоем толщиной в одну молекулу, А. называется мономолекулярной. Простейшая изотерма мономолекулярной А. представляет собой прямую линию, выходящую из начала координат, где на оси абсцисс отложено давление адсорбата Р, а на оси ординат степень заполнения поверхности Q , т. е. доля поверхности, покрытая адсорбированными молекулами. Это — т. н. изотерма Генри:
Q = kP.
Коэффициент пропорциональности k зависит главным образом от температуры и характера взаимодействия адсорбент — адсорбат.
Уравнение Генри справедливо при очень низких степенях заполнения для однородной поверхности. По мере увеличения степени заполнения всё большую роль начинает играть взаимодействие между адсорбированными молекулами и интенсивность их поверхностной подвижности. Если молекулы адсорбата притягиваются друг к другу, то каждая вновь адсорбирующаяся молекула будет испытывать притяжение и адсорбата и молекул, адсорбированных ранее. Поэтому, по мере заполнения поверхности, силы, удерживающие адсорбированную молекулу, будут увеличиваться и условия для А. будут всё более и более благоприятными. В этом случае с ростом давления изотерма всё круче и круче идёт вверх (см. кривую 1 ). Однако по мере заполнения поверхности вновь адсорбирующимися молекулами становится всё труднее найти свободное (не занятое др. молекулами адсорбата) место на поверхности. Поэтому с увеличением давления рост А. замедляется и степень покрытия стремится к постоянному значению, равному единице (см. кривую 2, которая характерна при отсутствии взаимного притяжения молекул адсорбата). Если действуют оба эти фактора, то получаются вогнуто-выпуклые изотермы (см. кривую 3 ).
Выпуклые изотермы (см. кривую 2 ) часто описывают уравнением Ленгмюра
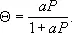
Здесь а — адсорбционный коэффициент, аналогичный по физическому смыслу константе Генри k . Уравнение Ленгмюра справедливо для мономолекулярной А. на однородной поверхности, если можно пренебречь притяжением молекул адсорбата между собой и их подвижностью вдоль поверхности.
Читать дальшеИнтервал:
Закладка:
