БСЭ БСЭ - Большая Советская Энциклопедия (АЗ)
- Название:Большая Советская Энциклопедия (АЗ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (АЗ) краткое содержание
Большая Советская Энциклопедия (АЗ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Синтез аминокислот происходит путём восстановительного аминирования ряда альдегидокислот и кетокислот , возникающих в результате окисления углеводов (В. Л. Кретович), или путём ферментативного переаминирования (А. Е. Браунштейн и М. Г. Крицман, 1937). Конечными продуктами усвоения аммиака микроорганизмами и растениями являются белки , входящие в состав протоплазмы и ядра клеток, а также отлагающиеся в виде запасных белков. Животные и человек способны лишь в огранической мере синтезировать аминокислоты. Они не могут синтезировать 8 незаменимых аминокислот (валин, изолейцин, лейцин, фенилаланин, триптофан, метионин, треонин, лизин), и потому для них основным источником азота являются белки, потребляемые с пищей, т. е., в конечном счёте, — белки растений и микроорганизмов.
Белки во всех организмах подвергаются ферментативному распаду, конечными продуктами которого являются аминокислоты. На следующем этапе в результате дезаминирования органический азот аминокислот вновь превращается в неорганический аммонийный азот. У микроорганизмов и особенно у растений аммонийный азот может использоваться для нового синтеза амидов и аминокислот. У животных обезвреживание аммиака, образующегося при распаде белков и нуклеиновых кислот, осуществляется путём синтеза мочевой кислоты (у пресмыкающихся и птиц) или мочевины (у млекопитающих, в том числе и у человека), которые затем выводятся из организма. С точки зрения обмена азота растения, с одной стороны, и животные (и человек), с другой, отличаются тем, что у животных утилизация образующегося аммиака осуществляется лишь в слабой мере — большая часть его выводится из организма; у растений же обмен азота «замкнут» — поступивший в растение азот возвращается в почву лишь вместе с самим растением.
Лит.: Прянишников Д. Н., Азот в жизни растений и в земледелии СССР, М. — Л., 1945; Браунштейн А. Е., Главные пути ассимиляции и диссимиляции азота у животных, «Баховские чтения», 1957, т. 12; Кретович В. Л., Биохимия автотрофной ассимиляции азота, там же, 1961, т. 16; Фердман Д. Л., Биохимия, 3 изд., М., 1966; Кретович В. Л. и Каган 3. С., Усвоение и превращение азота у растений, в кн.: Физиология сельскохозяйственных растений, т. 2, М., 1967.
В. Л. Кретович, З. С. Каган.
Азота окислы
Азо'та о'кислы,соединения азота с кислородом. Известны N 2O, NO, N 2O 3 , NO 2(и его димер N 2O 4), N 2O 5; есть сведения о существовании NO 3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе — при электроразряде из смеси азота с кислородом образуется окись азота NO, которая при охлаждении переходит в NO 2. Другие А. о. получают косвенным путём. N 2O 5— твёрдое вещество; остальные окислы при обычных условиях газообразны.
Закись азота N 2O — бесцветный газ со слабым приятным запахом и сладковатым вкусом; вдыхание смеси воздуха с N 2O вызывает состояние, напоминающее опьянение (отсюда название — веселящий газ). Плотность при 0°С и 101 325 н/м 2 (760 мм рт. ст. ) 1,9804 кг/м 3, t кип— 89,5°С, t пл— 102,4°С. 1 объём N 2O при 5°C растворяет 1,048 объёма N 2O. Химически N 2O с водой, растворами кислот и щелочей не реагирует, кислородом не окисляется. Выше 500°C разлагается: 2N 2O = 2N 2+ O 2; поэтому при повышенных температурах действует как сильный окислитель и поддерживает горение. Получают N 2O термическим разложением нитрата аммония: NH 4NO 3=N 2O+ 2H 2O. В медицине служит для общей анестезии.
Окись азота NO — бесцветный газ, буреющий при соприкосновении с воздухом вследствие окисления до NO 2. Плотность при 0°С и 101 325 н/м 2 (760 мм рт ст ) 1,3402 кг/м 3, t кип—151,8°С, t пл — 163,6°С. В воде мало растворима (0,0738 объёма в 1 объёме H 2O при 0°С). С водой, кислотами и щелочами химически не взаимодействует. Образует многочисленные продукты присоединения, например нитрозилхлорид NOCI. Получают NO действием разбавленной азотной кислоты на некоторые металлы, например: 3Cu + 8HNO 3= 3Cu(NO 3) 2+ 4H 2O + 2NO. Окись азота — важный полупродукт окисления аммиака при получении азотной кислоты .
Азотистый ангидрид (трёхокись азота) N 2O 3— в обычных условиях неустойчивое соединение. Разлагается уже при 0°С:
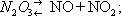
Около 3,5°С кипит с разложением, при 25°C содержит только 10% недиссоциированного N 2O 3. При низкой температуре может быть получен в виде тёмно-голубой жидкости, при сильном охлаждении — светло-голубой массы с t пл— 102°С. С водой образует азотистую кислоту : N 2O 3+ H 2O = 2HNO 2, со щелочами — соли (см. Нитриты ). N 2O 3получают по реакции: N 2O 4+ 2NO = 2N 2O 3; практического применения не находит.
Двуокись азота NO 2— бурый газ с удушливым запахом, при 21,15°C — буро-красная жидкость, бледнеющая при дальнейшем охлаждении из-за образования четырёхокиси азота N 2O 4, t отв —11,2°С. Взаимодействует с водой с образованием азотной кислоты и окиси азота: 3NO 2+ H 2O = 2HNO 3+ NO; со щелочами образует нитраты и нитриты. Двуокись азота — сильный окислитель; в токе NO 2энергично сгорают уголь, сера, фосфор, органические соединения. В промышленности NO 2получают окислением NO при производстве азотной кислоты, в лаборатории — термическим разложением некоторых нитратов: 2Pb(NO 3) 2= 2PbO + O 2+ 4NO 2. Применяют NO 2как нитрующий агент (см. Нитрование органических соединений).
Азотный ангидрид (пятиокись азота) N 2O 5— бесцветные очень летучие кристаллы. Крайне неустойчив и взрывоопасен. Взаимодействует с водой, давая азотную кислоту: N 2O 5+Н 2O = 2HNO 3, со щелочами образует соли — нитраты. В лаборатории получают по реакции: 2HNO 3+ P 2O 5= N 2O 5+ 2HPO 3. Практического применения не находит. Все А. о. физиологически активны.
Лит. см. при ст. Азот , Азотная кислота .
Азотирование
Азоти'рование,насыщение поверхности металлических деталей азотом с целью повышения твёрдости, износоустойчивости, предела усталости и коррозионной стойкости. А. подвергают сталь, титан, некоторые сплавы, наиболее часто — легированные стали, особенно хромоалюминиевые, а также сталь, содержащую ванадий и молибден.
Азотирование стали происходит при t 500—650 °С в среде аммиака. Выше 400 °С начинается диссоциация аммиака по реакции NH 3® 3H + N. Образовавшийся атомарный азот диффундирует в металл, образуя азотистые фазы. При температуре А. ниже 591 °С азотированный слой состоит из трёх фаз (рис.): e — нитрида Fe 2N, g' — нитрида Fe 4N, a — азотистого феррита, содержащего около 0,01% азота при комнатной температуре. При температуре А. 600—650° С возможно образование ещё и g-фазы, которая в результате медленного охлаждения распадается при 591°C на эвтектоид a + g 1. Твёрдость азотированного слоя увеличивается до HV = 1200 (соответствует 12 Гн/м 2 ) и сохраняется при повторных нагревах до 500—600°C, что обеспечивает высокую износоустойчивость деталей при повышенных температурах. Азотированные стали значительно превосходят по износоустойчивости цементированные и закалённые стали. А. — длительный процесс, для получения слоя толщиной 0,2—0,4 мм требуется 20—50 ч. Повышение температуры ускоряет процесс, но снижает твёрдость слоя. Для защиты мест, не подлежащих А., применяются лужение (для конструкционных сталей) и никелирование (для нержавеющих и жаропрочных сталей). Для уменьшения хрупкости слоя А. жаропрочных сталей иногда ведут в смеси аммиака и азота.
Читать дальшеИнтервал:
Закладка:
