БСЭ БСЭ - Большая Советская Энциклопедия (ВА)
- Название:Большая Советская Энциклопедия (ВА)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ВА) краткое содержание
Большая Советская Энциклопедия (ВА) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Ковалентность и гетеровалентность отражают специфику соответствующего типа химической связи. Для ковалентности важна насыщаемость связей, обусловливающая существование молекул в виде дискретных частиц с определённым составом и структурой. Ковалентность эффективна для органических и большинства простых неорганических соединений. Напротив, в случае гетеровалентности максимальное число ионов противоположного знака, способное разместиться вокруг данного иона, в основном определяется соотношениями их размеров. Ионная В. эффективна для сравнительно ограниченного класса соединений, в основном для различных солей щелочных, щёлочноземельных и некоторых др. металлов.
В. в комплексных соединениях. Ещё в конце прошлого века было найдено (А. Вернер , 1893), что многие соединения, как с максимальными (насыщенновалентные), так и с промежуточными В., типа ВСl 3, SiCl 4, PCl 5, CrCl 3и т.п., обладают склонностью к взаимодействию с другими насыщенновалентными соединениями — солями, окислами, молекулами типа H 2O, NH 3и др., с образованием довольно прочных комплексных соединений — K [BCl 4], K 2[SiCl 6], NH 4[PCl 6] и т.д. Исследования их строения рентгеновскими методами показали, что в комплексных анионах 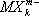 и катионах
и катионах 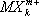 атомы лигандов Х обычно находятся в вершинах правильных многоугольников (октаэдра, тетраэдра и др.), а все связи М — Х одинаковы.
атомы лигандов Х обычно находятся в вершинах правильных многоугольников (октаэдра, тетраэдра и др.), а все связи М — Х одинаковы.
Для представлений о В. комплексные соединения необычны тем, что в них координационное число КЧ может быть больше общего числа валентных электронов атома М. Более того, в парамагнитных (см. Магнетохимия ) комплексах переходных и редкоземельных металлов — K 4[CrF 6], K 3[CrF 6], K 2[CrF 6] и др., некоторые электроны валентной оболочки остаются неспаренными и локализованными у центрального атома и практически не участвуют в связи. Классическая В. и КЧ, как правило, не совпадают, а способность к образованию октаэдрических и тетраэдрических. комплексов оказалась чрезвычайно распространённой и типичной для многих металлов и неметаллов, связанной сложной зависимостью с положением элемента в периодической системе и его В. в исходном простом соединении.
Поэтому было высказано предположение, что, наряду с «классической» В., которая реализуется в исходных простых соединениях типа ВСl 3, SiCl 4и др., атомы обладают также «координационной» В. (см. Донорно-акцепторная связь ), которая насыщается в комплексных соединениях (о природе координационной В. см. раздел 3). Предпринимались попытки описать связь в комплексных соединениях в рамках ионной теории, в которой считается, что анионы типа [PF 6] -и [МnO 4] -построены из ионов P 5++ 6F -и Mn 7++ 4O 2-и что В. центрального атома совпадает с зарядом его иона. Однако затраты энергии, необходимой для перевода 1 атома Mn и 4 атомов О в состояния Mn 7+и O 2-, далеко не компенсируются выигрышем в энергии при образовании связи. С появлением экспериментальных методов определения эффективных зарядов стало ясно, что эффективные заряды вообще редко превышают значения +1 или +2 у положительно заряженных и —1 у отрицательно заряженных атомов и обычно выражаются дробными долями заряда электрона (в перманганатном анионе заряд на Mn составляет лишь +1,5—+2,0 электрона). Поэтому ионная теория для большинства неорганических соединений, простых и комплексных, не может считаться корректной.
Успехи химии 20 в. и проблемы теории В. В 20 в. экспериментальной химией было синтезировано и изучено строение множества новых соединений, которые также оказалось невозможно уместить в рамки классических представлений о В. Оказалось, что склонность к образованию координационных соединений и насыщению координационных В. вообще чрезвычайно распространена и характерна практически для всех элементов и что суждения о В. на основании одного лишь стехиометрического состава очень часто оказываются несостоятельными без точных данных о структуре соединения и геометрическом расположении ближайшего окружения рассматриваемого атома. По мере развития структурных методов (см. Электронография молекул , Рентгенография молекул ) стало известно, что многие соединения с простым брутто-составом (AlCl 3, PdCl 2, MoO 3и др.), ранее считавшиеся простыми, в действительности даже в пара'х имеют димерное и полимерное строение — Al 2Cl 6, (PdCl 2) x( рис. 1 , а, б), (MoO 3) 2-5. В них «мостиковые» лиганды, соединённые одинаковыми связями с двумя атомами металлов (на рис. 1 они помечены цифрой 2), обладают координационным числом КЧ = 2. У соединений в твёрдом состоянии, которые часто построены ещё сложнее, КЧ галогенов и кислорода, ранее выбранного в качестве стандартного двухвалентного элемента, могут быть 3 и даже 4. В бороводородах каждый «мостиковый» атом водорода, считавшегося ранее стандартным одновалентным элементом, связан одинаковыми связями с двумя атомами бора ( рис. 1 , б). Алкильные группы также способны образовывать мостиковые связи в металлоорганических соединениях типа Al 2(CH 3) 6( рис. 1 , г) и др.
Для соединений переходных и ряда непереходных элементов оказалось характерным использование дополнительной В. за счёт образования связей металл — металл (кластерные соединения), при этом расстояние между атомами металлов оказалось значительно меньшим, чем в индивидуальных металлах. Например, в дигалогенидах молибдена и вольфрама во многих химических реакциях сохраняется неизменной группа 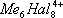 ( рис. 2 ), в которой атомы металла (Me) образуют правильный октаэдр; каждый атом Me связан с четырьмя другими атомами Me и с четырьмя атомами галогена (Hal), а каждый атом Hal связан с тремя атомами Me. Связи Me — Me в кластерах могут быть кратными (как, например, в
( рис. 2 ), в которой атомы металла (Me) образуют правильный октаэдр; каждый атом Me связан с четырьмя другими атомами Me и с четырьмя атомами галогена (Hal), а каждый атом Hal связан с тремя атомами Me. Связи Me — Me в кластерах могут быть кратными (как, например, в 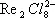 , где расстояние Re — Re на 0,5
, где расстояние Re — Re на 0,5 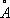 меньше, чем в металлическом Re, и на их образование атомы могут тратить не одну, а несколько В.
меньше, чем в металлическом Re, и на их образование атомы могут тратить не одну, а несколько В.
Недостаточность классического понимания В. видна также на примере так называемых «нуль-валентных» соединений, где атом металла связан исключительно с нейтральными молекулами; таковы карбонилы металлов типа Ti (CO) 7, Cr (CO) 6, Fe (CO) 5, аммиакаты типа Pt (NH 3) 4и т.д. В них вообще отсутствует классическое валентное взаимодействие (у атомов С и N в молекулах CO и NH 3нет неспаренных электронов), а связь осуществляется только за счёт координационных В. атома металла и молекул лигандов. Нейтральные лиганды часто оказываются мостиковыми и образуют по две, например в Co 4(CO) 12, и даже по три, например в Rh 6(CO) 16, связи.
Читать дальшеИнтервал:
Закладка:
