БСЭ БСЭ - Большая Советская Энциклопедия (ЖЕ)
- Название:Большая Советская Энциклопедия (ЖЕ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ЖЕ) краткое содержание
Большая Советская Энциклопедия (ЖЕ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Важную роль в геохимии Ж. играют окислительно-восстановительные реакции — переход 2-валентного Ж. в 3-валентное и обратно. В биосфере при наличии органических веществ Fe 3+восстанавливается до Fe 2+и легко мигрирует, а при встрече с кислородом воздуха Fe 2+окисляется, образуя скопления гидроокисей 3-валентного Ж. Широко распространённые соединения 3-валентного Ж. имеют красный, жёлтый, бурый цвета. Этим определяется окраска многих осадочных горных пород и их наименование — «красно-цветная формация» (красные и бурые суглинки и глины, жёлтые пески и т. д.).
Физические и химические свойства. Значение Ж. в современной технике определяется не только его широким распространением в природе, но и сочетанием весьма ценных свойств. Оно пластично, легко куется как в холодном, так и нагретом состоянии, поддаётся прокатке, штамповке и волочению. Способность растворять углерод и др. элементы служит основой для получения разнообразных железных сплавов.
Ж. может существовать в виде двух кристаллических решёток: a- и g- объёмноцентрированной кубической (ОЦК) и гранецентрированной кубической (ГЦК). Ниже 910 °С устойчиво a - Fe с ОЦК-решёткой (а = 2,86645 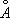 при 20°С). Между 910°С и 1400°С устойчива g-модификация с ГЦК-решёткой (а = 3,64
при 20°С). Между 910°С и 1400°С устойчива g-модификация с ГЦК-решёткой (а = 3,64 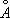 ). Выше 1400°С вновь образуется ОЦК-решётка d-Fe (а = 2,94
). Выше 1400°С вновь образуется ОЦК-решётка d-Fe (а = 2,94 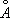 ), устойчивая до температуры плавления (1539°С). a - Fe ферромагнитно вплоть до 769°С (точка Кюри). Модификация g-Fe и d-Fe парамагнитны.
), устойчивая до температуры плавления (1539°С). a - Fe ферромагнитно вплоть до 769°С (точка Кюри). Модификация g-Fe и d-Fe парамагнитны.
Полиморфные превращения Ж. и стали при нагревании и охлаждении открыл в 1868 Д. К. Чернов . Углерод образует с Ж. твёрдые растворы внедрения, в которых атомы С, имеющие небольшой атомный радиус (0,77 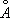 ), размещаются в междоузлиях кристаллической решётки металла, состоящей из более крупных атомов (атомный радиус Fe 1,26
), размещаются в междоузлиях кристаллической решётки металла, состоящей из более крупных атомов (атомный радиус Fe 1,26 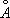 ). Твёрдый раствор углерода в g-Fe наз. аустенитом , а в (a-Fe— ферритом . Насыщенный твёрдый раствор углерода в g - Fe содержит 2,0% С по массе при 1130°С; a-Fe растворяет всего 0,02— 0,04%С при 723°С, и менее 0,01% при комнатной температуре. Поэтому при закалке аустенита образуется мартенсит— пересыщенный твёрдый раствор углерода в a- Fe, очень твёрдый и хрупкий. Сочетание закалки с отпуском (нагревом до относительно низких температур для уменьшения внутренних напряжений) позволяет придать стали требуемое сочетание твёрдости и пластичности (см. Железо - углеродистые сплавы . Термическая обработка металлов ).
). Твёрдый раствор углерода в g-Fe наз. аустенитом , а в (a-Fe— ферритом . Насыщенный твёрдый раствор углерода в g - Fe содержит 2,0% С по массе при 1130°С; a-Fe растворяет всего 0,02— 0,04%С при 723°С, и менее 0,01% при комнатной температуре. Поэтому при закалке аустенита образуется мартенсит— пересыщенный твёрдый раствор углерода в a- Fe, очень твёрдый и хрупкий. Сочетание закалки с отпуском (нагревом до относительно низких температур для уменьшения внутренних напряжений) позволяет придать стали требуемое сочетание твёрдости и пластичности (см. Железо - углеродистые сплавы . Термическая обработка металлов ).
Физические свойства Ж. зависят от его чистоты. В промышленных железных материалах Ж., как правило, сопутствуют примеси углерода, азота, кислорода, водорода, серы, фосфора. Даже при очень малых концентрациях эти примеси сильно изменяют свойства металла. Так, сера вызывает т. н. красноломкость , фосфор (даже 10 -20% Р) — хладноломкость ; углерод и азот уменьшают пластичность , а водород увеличивает хрупкость Ж. (т. н. водородная хрупкость). Снижение содержания примесей до 10 -7 — 10 -9% приводит к существенным изменениям свойств металла, в частности к повышению пластичности.
Ниже приводятся физические свойства Ж., относящиеся в основном к металлу с общим содержанием примесей менее 0,01% по массе:
Атомный радиус 1,26 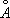
Ионные радиусы Fe 2+O,80 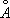 , Fe 3+O,67
, Fe 3+O,67 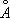
Плотность (20 oC) 7,874 г/см 3
t пл 1539°С
t kип около 3200 оС
Температурный коэффициент линейного расширения (20°С) 11,7·10 -6
Теплопроводность (25°С) 74,04 вт /( м·К )
[0,177 ( кал/см·сек·град )]
Теплоёмкость Ж. зависит от его структуры и сложным образом изменяется с температурой; средняя удельная теплоёмкость (0-1000 oC) 640,57 дж/ ( кг ·К) [0,153 кал/ ( г·град )].
Удельное электрическое сопротивление (20°С)
9,7·10 -8 ом·м [9,7·10 -6 ом·см ]
Температурный коэффициент электрического сопротивления
(0—100°С) 6,51·10 -3
Модуль Юнга 190—210·10 3 Мн/м. 2
(19-21·10 3 кгс/мм 2)
Температурный коэффициент модуля Юнга
4·10 -6
Модуль сдвига 84,0·10 3 Мн/м 2 [8,4·10 3 кгс/мм 2 ]
Кратковременная прочность на разрыв
170-210 Мн/м 2 [17-21 кгс/мм 2 ]
Относительное удлинение 45—55%
Твёрдость по Бринеллю 350—450 Мн/м 2
[35—45 кгс/мм 2 ]
Предел текучести 100 Мн/м 2 [10 кгс/мм 2 ]
Ударная вязкость 300 Мн/м 2 [30 кгс/мм 2 ]
Конфигурация внешней электронной оболочки атома Fe 3 d 6 4s 2 . Ж. проявляет переменную валентность (наиболее устойчивы соединения 2- и 3-валентного Ж.). С кислородом Ж. образует закись FeO, окись Fe 2O 3и закись-окись Fe 3O 4(соединение FeO с Fe 2O 3, имеющее структуру шпинели ) . Во влажном воздухе при обычной температуре Ж. покрывается рыхлой ржавчиной (Fe 2O 3· n H 2O). Вследствие своей пористости ржавчина не препятствует доступу кислорода и влаги к металлу и поэтому не предохраняет его от дальнейшего окисления. В результате различных видов коррозии ежегодно теряются миллионы тонн Ж. (см. Коррозия металлов). При нагревании Ж. в сухом воздухе выше 200°С оно покрывается тончайшей окисной плёнкой, которая защищает металл от коррозии при обычных температурах; это лежит в основе технического метода защиты Ж. — воронения. При нагревании в водяном паре Ж. окисляется с образованием Fe 3O 4(ниже 570°С) или FeO (выше 570°С) и выделением водорода.
Гидроокись Fe (OH) 2образуется в виде белого осадка при действии едких щелочей или аммиака на водные растворы солей Fe 2+в атмосфере водорода или азота. При соприкосновении с воздухом Fe (OH) 2сперва зеленеет, затем чернеет и наконец быстро переходит в красно-бурую гидроокись Fe (OH) 3. Закись FeO проявляет основные свойства. Окись Fe 2O 3амфотерна и обладает слабо выраженной кислотной функцией; реагируя с более основными окислами (например, с MgO), она образует ферриты — соединения типа Fe 2O 3· n MeO, имеющие ферромагнитные свойства и широко применяющиеся в радиоэлектронике. Кислотные свойства выражены и у 6-валентного Ж., существующего в виде ферратов, например K 2FeO 4, солей не выделенной в свободном состоянии железной кислоты.
Ж. легко реагирует с галогенами и галогеноводородами, давая соли, например хлориды FeCl 2и FeCl 3. При нагревании Ж. с серой образуются сульфиды FeS и FeS 2. Карбиды Ж. — Fe 3C ( цементит ) и Fe 2C (e-карбид) — выпадают из твёрдых растворов углерода в Ж. при охлаждении. Fe 3C выделяется также из растворов углерода в жидком Ж. при высоких концентрациях С. Азот, подобно углероду, даёт с Ж. твёрдые растворы внедрения; из них выделяются нитриды Fe 4N и Fe 2N. С водородом Ж. даёт лишь малоустойчивые гидриды, состав которых точно не установлен. При нагревании Ж. энергично реагирует с кремнием и фосфором, образуя силициды (например, Fe 3Si) и фосфиды (например, Fe 3P).
Читать дальшеИнтервал:
Закладка:
