БСЭ БСЭ - Большая Советская Энциклопедия (КА)
- Название:Большая Советская Энциклопедия (КА)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (КА) краткое содержание
Большая Советская Энциклопедия (КА) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Для сельского хозяйства характерно сочетание интенсивного земледелия (главным образом на орошаемых землях) с экстенсивным скотоводством. Около 2/ 3товарной продукции составляют продукты земледелия: различные фрукты и овощи (главным образом в Калифорнийской долине), цитрусовые (в Лос-Анджелесском районе), длинноволокнистый хлопок (в бассейне р. Колорадо). Поголовье скота (1969): крупного рогатого около 4 млн., овец 1,5 млн. Рыболовство. На С. значительны лесозаготовки и деревообработка. Туризм. Длина железных дорог около 13 тыс. км (1968). Автомобилей около 10 млн. (1969). Большую роль играет морской транспорт. Главные порты: Сан-Франциско, Лос-Анджелес. В пределах К. размещены военные базы США.
Европейцы посещали территорию К. с 16 в. В 18 в. началась колонизация К. испанцами, сопровождавшаяся истреблением местного индейского населения. Большую роль в исследовании и экономическом освоении К. сыграли русские поселенцы. После провозглашения независимости Мексики (1821) территория К. вошла в её состав. В результате захватнической войны США против Мексики (см. Американо-мексиканская война 1846—48 ) К. была отторгнута от Мексики и присоединена к США; в 1850 получила права штата.
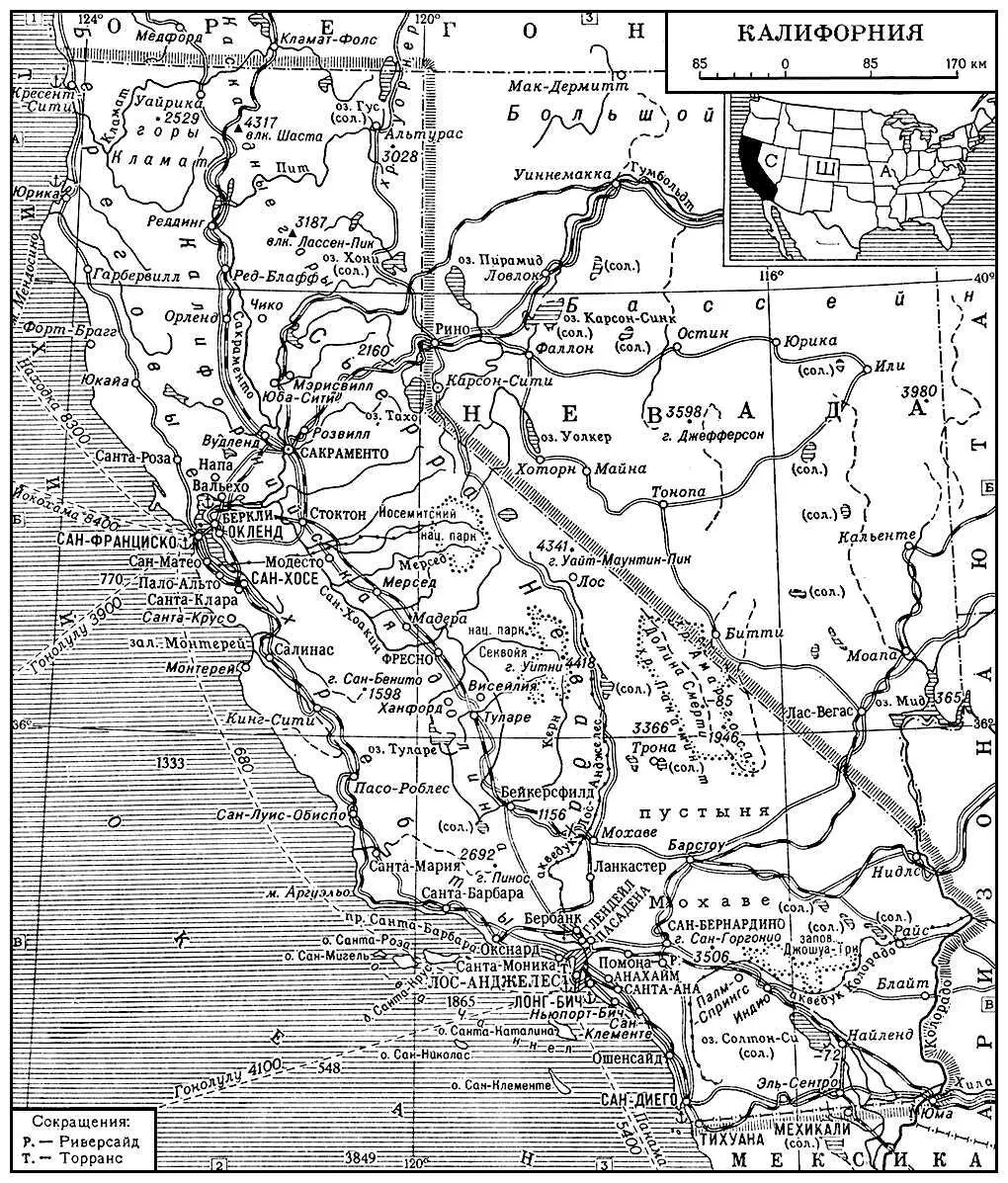
Калифорния.
Калицкий Казимир Петрович
Кали'цкийКазимир Петрович [4(16).3.1873, Петербург, — 28.12.1941, Ленинград], советский геолог-нефтяник, доктор геолого-минералогических наук, профессор (1941). Окончил Петербургский горный институт (1899). С 1901 работал в Геологическом комитете, а после его реорганизации — во Всесоюзном нефтяном научно-исследовательском геологоразведочном институте. Провёл многочисленные геологические исследования во многих нефтеносных районах СССР (Средняя Азия, Кавказ, Поволжье и др.). Основные работы посвящены проблеме генезиса нефти и формирования её залежей. Развивал гипотезу происхождения нефти из морских растений. Считал, что миграция нефти не играет роли в формировании нефтяных залежей. К. составил один из первых учебников по геологии нефти (1921).
Соч.: Научные основы поисков нефти, М. — Л., 1944.
Лит.: Ежегодник Всероссийского Палеонтологического общества, т. 13, М. — Л., 1949, с. 129—30; Саббатовский Г. К., Значение трудов К. П. Калицкого в познании геологических нефтяных месторождений Туркмении, «Тр. института геологии АН Туркменской ССР», 1960, т. 3.
Калиш
Ка'лиш(Kalisz), город в Польше, в Познанском воеводстве, на р. Просна. 82 тыс. жителей (1971). Транспортный узел. Центр текстильной промышленности (шёлк, бархат, тюль, трикотаж). Машиностроение, пищевая промышленность; производство пианино, пластиковых изделий. Известен со 2 в. н. э.
Лит.: Dabrowski К., Z przeszłosci Kalisza, [Warsz., 1970].
Калишский союзный договор 1813
Ка'лишский сою'зный догово'р 1813,договор России и Пруссии о войне против французского императора Наполеона I. Подписан после изгнания остатков наполеоновской армии из России фельдмаршалом М. И. Кутузовым и прусским канцлером К. А. Гарденбергом 15 (27) февраля в Бреславле и 16 (28) февраля в г. Калише — ставке Александра I. Россия и Пруссия договаривались вести совместные военные действия и не заключать сепаратного мира или перемирия. Секретными пунктами К. с. д. предусматривалось восстановление Пруссии в границах 1806 и увеличение её территории за счёт северо-германских государств. К. с. д. положил начало 6-й антинаполеоновской коалиции (см. Наполеоновские войны ).
Лит.: История дипломатии, 2 изд., т. 1, М.. 1963.
Калия бихромат
Ка'лия бихрома'т,калия дихромат, двухромовокислый калий, K 2Cr 2O 7, см. Дихроматы .
Калия бромид
Ка'лия броми'д,бромистый калий, KBr, соль; бесцветные кристаллы, плотность 2,75 г/см 3 , t пл748 °С. Растворимость 65,6 г в 100 г H 2O при 20 °С и 105 г при 100 °С. Получают взаимодействием водных растворов поташа и бромида железа (II, III): 4K 2CO 3+ Fe 3Br 2= 8KBr + Fe 3O 4+ 4CO 2.
Применяется для приготовления светочувствительных фотоматериалов и в медицине.
Калия гексацианоферриат
Ка'лия гексацианоферриа'т,железосинеродистый калий, феррицианид калия, красное синькали, красная кровяная соль, K 3[Fe (CN) 6], комплексное соединение 3-валентного железа; тёмно-красные кристаллы, плотность 1,86 г/см 3 . Получают окислением калия гексацианоферроата . С ионом Fe 2+К. г. образует тёмно-синий осадок турнбулевой сини Fe 3[Fe (CN) 6] 2, что используют в аналитической химии. К. г. применяют также для ослабления фотографического .
Калия гексацианоферроат
Ка'лия гексацианоферроа'т,железосинеродистый калий, ферроцианид калия, жёлтое синькали, жёлтая кровяная соль, K 4[Fe (CN) 6]·3H 2O, комплексное соединение 2-валентного железа; светло-желтые кристаллы, устойчивые на воздухе, плотность 1,85 г/см 3 . К. г. получали нагреванием рогов, копыт, крови с K 2CO 3и железными опилками (отсюда название «жёлтая кровяная соль»). Применяют как реактив на ионы Fe 3+, с которыми К. г. образует синий осадок берлинской лазури Fe 4[Fe (CN) 6] 3, и в др. областях аналитической химии; в промышленности — для производства красок, K 3[Fe (CN) 6] и др.
Калия гидроокись
Ка'лия гидроо'кись,едкое кали, KOH, сильная щёлочь; бесцветные кристаллы, плотность 2,12 г/см 3 (25 °С), t пл380 °С. В воде растворяется легко, со значительным выделением тепла; в 100 г H 2O растворяется 97 г при О °С и 112 г при 20 °С. Промышленностью выпускается в виде белой твёрдой непрозрачной массы, содержащей 90—92% KOH и представляющей смесь KOH и KOH·H 2O. На воздухе KOH поглощает H 2O и CO 2и расплывается, постепенно превращаясь в калия карбонат K 2CO 3. Разрушает кожу, бумагу, шерсть, шёлк и др. материалы органического происхождения. На коже человека вызывает сильные ожоги; особенно опасно попадание в глаза. При работе с К. г. необходимо надевать защитные очки и резиновые перчатки. К. г. получают электролизом растворов калия хлорида . Применяют в производстве жидких мыл, как исходный материал для получения солей калия, используют в щелочных аккумуляторах и как реактив в лабораториях.
Калия дихромат
Ка'лия дихрома'т,калия бихромат, двухромовокислый калий, K 2Cr 2O 7, см. Дихроматы .
Калия иодид
Ка'лия иоди'д,иодистый калий, KI, соль; бесцветные кристаллы, плотность 3,115 г/см 3 , t пл686 °С. Растворимость 144,5 г в 100 г H 2O при 20 °С и 209 г при 100 °С. На свету окисляется кислородом воздуха с выделением иода. Получают взаимодействием водных растворов Fel 2и K 2CO 3. Применяют для приготовления светочувствительных фотоматериалов и в медицине.
Читать дальшеИнтервал:
Закладка:
