БСЭ БСЭ - Большая Советская Энциклопедия (КО)
- Название:Большая Советская Энциклопедия (КО)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (КО) краткое содержание
Большая Советская Энциклопедия (КО) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Различают простую и сложную, или комплексную, К. Простая К. — результат взаимодействия растворённого полимера с низкомолекулярным веществом (например, желатины со спиртом или сульфатом натрия). Сложная К. наблюдается при взаимодействии двух полимеров, макромолекулы которых несут противоположные заряды (например, при смешении водных растворов желатины и гуммиарабика). К. возможна при содержании полимера в растворе в количестве десятых и даже сотых долей %, причём концентрация вещества в коацерватных каплях может достигать нескольких десятков %. Поэтому К. используют как метод концентрирования и фракционирования нативных и денатурированных биополимеров (в частности, водорастворимых белков), а также синтетических полимеров. По гипотезе А. И. Опарина о путях возникновения жизни на Земле, К. принадлежит важная роль в сосредоточении белковых веществ в обособленных участках объема окружающей среды. Согласно этой гипотезе, объединение отдельных гидратированных макромолекул в молекулярные «рои» и последующее их скапливание в коацерватных каплях привели к появлению предбиологических систем в водах первичного океана, покрывавшего в отдалённые геологические эпохи земную поверхность (см. Происхождение жизни ) .
Лит.: Серебровская К. Б., Коацерваты и протоплазма, М., 1971; Евреинова Т. Н., Концентрирование веществ и действие ферментов в коацерватах, М., 1966; Пасынский А. Г., Коллоидная химия, М.. 1968, с. 166; Colloid Science, [ed. Н. R. Kruyt], v. 2, N. Y. [a. o.], 1949 (статья Н. G. Bunoenberg de Jong).
Л. А. Шиц.
Кобадиан
Кобадиа'н,древний бактрийский город (современное городище Калаи-Мир ) в низовьях р. Кафирниган, на территории Таджикской ССР.
Кобаламины
Кобалами'ны,природные биологически активные кобальторганические соединения. Структурной основой К. является корриновое кольцо, состоящее из 4 пиррольных ядер, у которых атомы азота связаны с центральным атомом кобальта. Наиболее известно три К., различающиеся природой заместителя при атоме кобальта: цианкобаламин, или витамин B 12, и его коферментные формы (см. Коферменты ) : метилкобаламин и 5'-дезоксиаденозилкобаламин. Витамин В 12 — продукт жизнедеятельности кишечной флоры. Если по какой-либо причине всасывание витамина B 12нарушается, у человека (или животного) развивается авитаминоз B 12. К. отлагаются в печени в виде 5’'-дезоксиаденозилкобаламина, принимающего участие в ряде ферментативных реакций, сопровождающихся внутримолекулярными перегруппировками. Метилкобаламин участвует в биосинтезе аминокислоты метионина, метана и уксусной кислоты. В промышленном масштабе витамин B 12получают методом микробиологического синтеза.
Кобальт
Ко'бальт(лат. Cobaltum), Со, химический элемент первой триады VIII группы периодической системы Менделеева; атомный номер 27, атомная масса 58,9332; тяжёлый металл серебристого цвета с розоватым отливом. В природе элемент представлен одним устойчивым изотопом 59Со; из полученных искусственно радиоактивных изотопов важнейший 60Со.
Историческая справка. Окись К. применялась в Древнем Египте, Вавилоне, Китае для окрашивания стекол и эмалей в синий цвет. Для той же цели в 16 в. в Западной Европе стали пользоваться цафрой, или сафлором, — серой землистой массой, которая получалась при обжиге некоторых руд, носивших название «кобольд». Эти руды выделяли при обжиге обильный ядовитый дым, а из продукта их обжига выплавить металл не удавалось. Средневековые рудокопы и металлурги считали это проделками мифических существ — кобольдов (от нем. Kobold — домовой, гном). В 1735 шведский химик Г. Брандт, нагревая в горне с дутьём смесь цафры с углем и флюсом, получил металл, который назвал «корольком кобольда». Вскоре это название было изменено на «кобольт», а затем на «кобальт».
Распространение в природе. Содержание К. в литосфере 1,8·10 -3% по массе. В земной коре он мигрирует в магмах, горячих и холодных водах. При магматической дифференциации К. накапливается главным образом в верхней мантии: его среднее содержание в ультраосновных породах 2·10 -2%. С магматическими процессами связано образование так называемых ликвационных месторождений кобальтовых руд. Концентрируясь из горячих подземных вод, К. образует гидротермальные месторождения; в них Со связан с Ni, As, S, Cu. Известно около 30 минералов К. (см. Кобальтовые руды ) .
В биосфере К. преимущественно рассеивается, однако на участках, где есть растения — концентраторы К., образуются кобальтовые месторождения. В верхней части земной коры наблюдается резкая дифференциация К. — в глинах и сланцах в среднем содержится 2·10 -3% К., в песчаниках 3·10 -5, в известняках 1·10 -5. Наиболее бедны К. песчаные почвы лесных районов. В поверхностных водах К. мало, в Мировом океане его лишь 5·10 -8%. Будучи слабым водным мигрантом, К. легко переходит в осадки, адсорбируясь гидроокисями марганца, глинами и др. высокодисперсными минералами.
Физические и химические свойства. При обычной температуре и до 417°С кристаллическая решётка К. гексагональная плотноупакованная (с периодами а = 2,5017 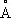 , с = 4,614
, с = 4,614 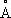 ), выше этой температуры решётка К. кубическая гранецентрированная (а = 3,5370
), выше этой температуры решётка К. кубическая гранецентрированная (а = 3,5370 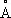 ). Атомный радиус 1,25
). Атомный радиус 1,25 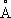 , ионные радиусы Co 2+0,78
, ионные радиусы Co 2+0,78 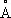 и Co 3+0,64
и Co 3+0,64 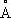 . Плотность 8,9 г/см 3(при 20°С): t nл1493° С о, t к ип3100°С. Теплоёмкость 0,44 кдж/ ( кг·К ) , или 0,1056 кал/( г· °С); теплопроводность 69,08 вт/ ( м·К ) , или 165 кал/ ( см·сек· ° С ) при 0—100 °С. Удельное электросопротивление 5,68·10 -8 ом·м, или 5,68·10 -6 ом·см (при 0°С). К. ферромагнитен, причём сохраняет ферромагнетизм от низких температур до точки Кюри, Q= 1121 °С (см. Ферромагнетизм ) . Механические свойства К. зависят от способа механической и термической обработки. Предел прочности при растяжении 500 Мн/м 2 (или 50 кгс/мм 2 ) для кованого и отожжённого К.; 242— 260 Мн/м 2 для литого; 700 Мн/м 2 для проволоки. Твёрдость по Бринеллю 2,8 Гн/м 2 (или 280 кгс/мм 2 ) для наклёпанного металла, 3,0 Гн/м 2 для осажденного электролизом; 1,2—1,3 Гн/м 2 для отожжённого.
. Плотность 8,9 г/см 3(при 20°С): t nл1493° С о, t к ип3100°С. Теплоёмкость 0,44 кдж/ ( кг·К ) , или 0,1056 кал/( г· °С); теплопроводность 69,08 вт/ ( м·К ) , или 165 кал/ ( см·сек· ° С ) при 0—100 °С. Удельное электросопротивление 5,68·10 -8 ом·м, или 5,68·10 -6 ом·см (при 0°С). К. ферромагнитен, причём сохраняет ферромагнетизм от низких температур до точки Кюри, Q= 1121 °С (см. Ферромагнетизм ) . Механические свойства К. зависят от способа механической и термической обработки. Предел прочности при растяжении 500 Мн/м 2 (или 50 кгс/мм 2 ) для кованого и отожжённого К.; 242— 260 Мн/м 2 для литого; 700 Мн/м 2 для проволоки. Твёрдость по Бринеллю 2,8 Гн/м 2 (или 280 кгс/мм 2 ) для наклёпанного металла, 3,0 Гн/м 2 для осажденного электролизом; 1,2—1,3 Гн/м 2 для отожжённого.
Конфигурация внешних электронных оболочек атома К. 3 d 74s 2. В соединениях К. проявляет переменную валентность. В простых соединениях наиболее устойчив Со (II), в комплексных — Со (III). Для Со (I) и Co (IV) получены только немногочисленные комплексные соединения. При обыкновенной температуре компактный К. стоек против действия воды и воздуха. Мелко раздробленный К., полученный восстановлением его окиси водородом при 250 °С (пирофорный К.), на воздухе самовоспламеняется, превращаясь в СоО. Компактный К. начинает окисляться на воздухе выше 300 °С; при красном калении он разлагает водяной пар: Со + H 2O = CoO + H 2. С галогенами К. легко соединяется при нагревании, образуя галогениды СоХ 2. При нагревании К. взаимодействует с S, Se, Р, As, Sb, С, Si, В, причём состав получающихся соединений иногда не удовлетворяет указанным выше валентным состояниям (например, Со 2Р, Co 2As, CoSb 2, Со 3С, CoSi 3). В разбавленных соляной и серной кислотах К. медленно растворяется с выделением водорода и образованием соответственно хлорида CoCl 2и сульфата CoSO 4. Разбавленная азотная кислота растворяет К. с выделением окислов азота и образованием нитрата Co (NO 3) 2. Концентрированная HNO 3пассивирует К. (см. Пассивирование металлов ) . Названные соли Со (II) хорошо растворимы в воде [при 25 °С 100 г воды растворяют 52,4 г CoCl 2, 39,3 г CoSO 4, 136,4 г. Со (NO 3) 2]. Едкие щёлочи осаждают из растворов солей Со 2+синюю гидроокись Со (ОН) 2, которая постепенно буреет вследствие окисления кислородом воздуха до Со (ОН) 3. Нагревание в кислороде при 400—500 °С переводит CoO в чёрную закись-окись Co 3O 4, или CoO·Co 2O 3— соединение типа шпинели. Соединение того же типа CoAl 2O 4или CoAl 2O 3синего цвета (тенарова синь, открытая в 1804 Л. Ж. Тенаром) получается при прокаливании смеси CoO и Al 2O 3при температуре около 1000 °С.
Читать дальшеИнтервал:
Закладка:
