БСЭ БСЭ - Большая Советская Энциклопедия (ЛИ)
- Название:Большая Советская Энциклопедия (ЛИ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ЛИ) краткое содержание
Большая Советская Энциклопедия (ЛИ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Л. образует многочисленные литийорганические соединения , что определяет его большую роль в органическом синтезе.
Л. — компонент многих сплавов. С некоторыми металлами (Mg, Zn, Al) он образует твёрдые растворы значительной концентрации, со многими — интерметаллиды (LiAg, LiHg, LiMg 2, LiAl и мн. др.). Последние часто весьма тверды и тугоплавки, незначительно изменяются на воздухе; некоторые из них — полупроводники. Изучено более 30 бинарных и ряд тройных систем с участием Л.; соответствующие им сплавы уже нашли применение в технике.
Получение и применение. Соединения Л. получаются в результате гидрометаллургической переработки концентратов — продуктов обогащения литиевых руд. Основной силикатный минерал — сподумен перерабатывают по известковому, сульфатному и сернокислотному методам. В основе первого — разложение сподумена известняком при 1150—1200°С:
Li 2O×Al 2O 3×4SiO 2+ 8CaCO 3= Li 2OAl 2O 3+ 4(2CaO×SiO 2) + 8CO 2.
При выщелачивании спека водой в присутствии избытка извести алюминат Л. разлагается с образованием гидроокиси Л.:
Li 2O×Al 2O 3+ Ca(OH) 2= 2LiOH + CaO×Al 2O 3.
По сульфатному методу сподумен (и др. алюмосиликаты) спекают с сульфатом калия:
Li 2O×Al 2O 3×4SiO 2+ K 2SO 4= Li 2SO 4+ K 2O×Al 2O 3×4SiO 2.
Сульфат Л. растворяют в воде и из его раствора содой осаждают карбонат Л.:
Li 2SO 4+ Na 2CO 3= Li 2CO 3 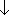 + Na 2SO 4.
+ Na 2SO 4.
По сернокислотному методу также получают сначала раствор сульфата Л., а затем карбонат Л.; сподумен разлагают серной кислотой при 250—300°С (реакция применима только для b-модификации сподумена):
b-Li 2O×Al 2O 3×4SiO 2+ H 2SO 4= Li 2SO 4+ H 2O×Al 2O 3×4SiO 2.
Метод используется для переработки руд, необогащённых сподуменом, если содержание в них Li 2O не менее 1%. Фосфатные минералы Л. легко разлагаются кислотами, однако по более новым методам их разлагают смесью гипса и извести при 950—1050°С с последующей водной обработкой спеков и осаждением из растворов карбоната Л.
Металлический Л. получают электролизом расплавленной смеси хлоридов Л. и калия при 400—460°С (весовое соотношение компонентов 1:1). Электролизные ванны футеруются магнезитом, алундом, муллитом, тальком, графитом и др. материалами, устойчивыми к расплавленному электролиту; анодом служат графитовые, а катодом — железные стержни. Черновой металлический Л. содержит механические включения и примеси (К, Mg, Ca, Al, Si, Fe, но главным образом Na). Включения удаляются переплавкой, примеси — рафинированием при пониженном давлении. В настоящее время большое внимание уделяется металлотермическим методам получения Л.
Важнейшая область применения Л. — ядерная энергетика . Изотоп 6Li — единственный промышленный источник для производства трития (см. Водород ) по реакции:
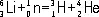 .
.
Сечения захвата тепловых нейтронов (s) изотопами Л. резко различаются: 6Li 945, 7Li 0,033; для естественной смеси 67 (в барнах ); это важно в связи с техническим применением Л. — при изготовлении регулирующих стержней в системе защиты реакторов. Жидкий Л. (в виде изотопа 7Li) используется в качестве теплоносителя в урановых реакторах. Расплавленный 7LiF применяется как растворитель соединений U и Th в гомогенных реакторах. Крупнейшим потребителем соединений Л. является силикатная промышленность, в которой используют минералы Л., LiF, Li 2CO 3и многие специально получаемые соединения. В чёрной металлургии Л., его соединения и сплавы широко применяют для раскисления, легирования и модифицирования многих марок сплавов. В цветной металлургии литием обрабатывают сплавы для получения хорошей структуры, пластичности и высокого предела прочности. Хорошо известны алюминиевые сплавы, содержащие всего 0,1% Л., — аэрон и склерон; помимо лёгкости, они обладают высокой прочностью, пластичностью, стойкостью против коррозии и очень перспективны для авиастроения. Добавка 0,04% Л. к свинцово-кальциевым подшипниковым сплавам повышает их твёрдость и понижает трение. Соединения Л. используются для получения пластичных смазок . По значимости в современной технике Л. — один из важнейших редких элементов.
В. Е. Плющев.
Литий в организме. Л. постоянно входит в состав живых организмов, однако его биологическая роль выяснена недостаточно. Установлено, что у растений Л. повышает устойчивость к болезням, усиливает фотохимическую активность хлоропластов в листьях (томаты) и синтез никотина (табак). Способность концентрировать Л. сильнее всего выражена среди морских организмов у красных и бурых водорослей, а среди наземных растений — у представителей семейства Ranunculaceae (василистник, лютик) и семейства Solanaceae (дереза). У животных Л. концентрируется главным образом в печени и лёгких.
Лит.: Плющев В. Е., Степин Б. Д., Химия и технология соединений лития, рубидия и цезия, М., 1970; Ландольт П., Ситтиг М., Литий, в кн.: Справочник по редким металлам, пер. с англ., М., 1965.
Литийорганические соединения
Литийоргани'ческие соедине'ния, соединения, содержащие связь углерод — литий, R — Li. Алифатические Л. с. — бесцветные кристаллические вещества (R = СН 3, C 2H 5трет-С 4Н 9), вязкие неперегоняющиеся жидкости (R = н - С 3Н 7— н - C 12H 25) или низкоплавкие воскообразные вещества (R — высшие алкилы); хорошо растворимы в углеводородах (кроме CH 3Li) и эфирах. Ароматические Л. с. — белые или желтоватые кристаллические вещества, нерастворимые в углеводородах, растворимые в эфирах.
Обычно Л. с. получают при взаимодействии металлического лития с хлористыми или бромистыми алкилами (или арилами) в углеводородной или эфирной среде:
RX + 2Li ® Rli + LiX.
Полученные растворы непосредственно используют для синтеза различных классов соединений. При нагревании лития с ртутьорганическими соединениями (также в углеводородной среде) получают растворы Л. с., не содержащие галогенида лития. Из этих растворов могут быть выделены индивидуальные Л. с.
Л. с. вступают в те же реакции, что и магнийорганические соединения (см. Гриньяра реакция ), однако значительно превосходят последние по реакционной способности; крайне чувствительны к воздействию кислорода, влаги и углекислого газа, поэтому все операции с ними проводят в атмосфере сухого инертного газа (азота или аргона); с бромистым литием и эфиром образуют комплексы типа 2RLi×LiBr×(C 2H 5) 2O.
Л. с. широко применяют в органическом синтезе, особенно в тех случаях, когда соответствующий реактив Гриньяра недостаточно активен; в промышленности они нашли применение как катализаторы при получении бутадиеновых каучуков и изопреновых каучуков .
Лит.: Талалаева Т. В., Кочешков К. А., Методы элементоорганической химии, под ред. А. Hi Несмеянова и К. А. Кочешкова. Литий, натрий, калий, рубидий, цезий, кн. 1—2, М., 1971.
Читать дальшеИнтервал:
Закладка:
