БСЭ БСЭ - Большая Советская Энциклопедия (МЕ)
- Название:Большая Советская Энциклопедия (МЕ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (МЕ) краткое содержание
Большая Советская Энциклопедия (МЕ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Меди галогениды
Ме'ди галогени'ды, соединения меди с галогенами: CuX и CuX 2(где Х — F, Cl, Br и I). Способность раствора CuCI в концентрированной соляной кислоте абсорбировать на холоду окись углерода CO с образованием CuCICO используется в газовом анализе. Из галогенидов 2-валентной меди применяют главным образом CuCl 2(протрава при крашении, катализатор).
Меди карбонаты
Ме'ди карбона'ты, углекислые соли меди. Средний (нормальный) М. к. не получен. В природе встречаются минералы — изумрудно-зелёный малахит состава CuCO 3×Cu(OH) 2и небесно-голубой азурит 2CuCO 3×Cu(OH) 2. Действием Na 2CO 3на CuSO 4в водном растворе получают основной карбонат состава CuCO 3×Cu(OH) 2×0,5H 2O, при нагревании он переходит в малахит. М. к. неустойчивы и при температуре выше 200 °С разлагаются на CuO, CO 2и H 2O. В воде М. к. нерастворимы. В аммиаке растворяются в присутствии солей аммония. Азурит применяют как пигмент, а также в пиротехнике, металлургии и другом, азурит и малахит — для изготовления поделок и ювелирных изделий.
Меди нитрат
Ме'ди нитра'т, азотнокислая медь, Cu(NO 3) 2, белые (чуть зеленоватые) кристаллы. При нагревании разлагаются на CuO, NO 2и O 2. Безводная Cu(NО 3) 2может быть получена из её концентрированных азотнокислых растворов. Чаще всего из водных растворов выделяется Сu(NO 3) 2×6H 2O — синие кристаллы с плотностью 2,07 г/см 3 , расплывающиеся на воздухе. Более устойчив при обычной температуре Cu(NO 3) 2×3Н 2О — тёмно-голубые кристаллы. М. н. легко растворим в воде и спирте (в 100 г H 2O при 20 °С растворяется 125,2 г безводной соли). М. н. используется для приготовления красок. Нитрат одновалентной меди существует только в растворах и в свободном состоянии не выделен.
Меди окислы
Ме'ди о'кислы, соединения меди с кислородом: оксид М. (I) — закись Cu 2O, оксид М. (II) — окись CuO, оксид М. (Ill) — Cu 2O 3и перекись CuO 2. Окисел Cu 2O 3нестоек, см. Медь . Окись меди CuO встречается в природе в виде минерала тенорита (мелаконита) чёрного цвета. CuO неустойчива, разлагается начиная с 800 °С. Хорошо растворяется в растворах цианидов и в кислотах (последнее используется в гидрометаллургии меди). При взаимодействии солей 2-валентной меди со щелочами в растворах выпадает гидроокись Cu(OH) 2в виде объёмистого голубого осадка. Свежевыпавшая Cu(OH) 2заметно растворима в щелочах, однако её кислотный характер выражен очень слабо; отвечающие ей соли, например Na 2CuO 2, называются купритами. В водном аммиаке Cu(OH) 2образует раствор [Сu(NH 3) 4](OH) 2синего цвета, способный растворять целлюлозу; при разбавлении или подкислении раствора целлюлоза вновь выпадает в осадок; это используют при производстве искусственного шёлка. Окись меди применяют в стекольной и эмалевой промышленности как зелёный и голубой красители, для получения рубинового стекла и так далее.
Закись меди Сu 2O образует минерал куприт красно-бурого цвета. Плавится при 1230 °С без разложения. Водородом и окисью углерода Cu 2O легко восстанавливается до металла. В разбавленной серной кислоте Cu 2O растворяется полностью только в присутствии кислорода. В концентрированной H 2SO 4растворяется с выделением SO 2. Получают Cu 2O прокаливанием меди при недостатке воздуха. Применяют для окрашивания стекла, эмалей и для борьбы с вредителями в сельском хозяйстве.
Меди сульфат
Ме'ди сульфа'т, сернокислая медь, CuSO 4, бесцветные кристаллы, плотность 3,64 г/см 3 . При нагревании разлагается (CuSO 4= CuO + SO 2+ 1/ 2O 2). В воде хорошо растворим (23,05 г CuSO 4в 100 г H 2O при 25 °С). Из водных растворов М. с. кристаллизуется CuSO 4×5H 2O — медный купорос (ярко-синего цвета), который при нагревании выше 105 °С переходит в CuSO 4×3H 2O (голубого цвета); полностью обезвоживается при 258 °С. В природе встречается в виде минерала халькантита CuSO 4×5H 2O. В промышленности медный купорос получают растворением меди в нагретой разбавленной серной кислоте при продувании воздуха или как побочный продукт электролитического рафинирования меди . Применяют при получении минеральных красок, в сельском хозяйстве для борьбы с вредителями и болезнями растений и для протравливания зерна, при выделке кож, в гальванических элементах.
Меди сульфиды
Ме'ди сульфи'ды,соединения меди с серой, Cu 2S и CuS. Из них Cu 2S встречается в виде минерала халькозина с плотностью 5,5—5,8 г/см 3 черновато-свинцово-серого цвета (известны 3 модификации). При нагревании Cu 2S окисляется с образованием CuO и SO 2(или CuSO 4). В воде, разбавленных кислотах и аммиачных растворах практически нерастворима. Растворяется в водных растворах FeSO 4, цианидов и CuCl 2. В горячей HNO 3растворяется с выделением элементарной серы.
CuS образует минерал ковеллин черновато-синего цвета с плотностью 4,68 г/см 3. При нагревании выше 450 °С разлагается на Cu 2S и серу. Легко окисляется. Из слабокислых растворов солей меди H 2S осаждает чёрный CuS.
На большом сродстве Си к S основаны пирометаллургические методы получения меди.
Медиальный
Медиа'льный(позднелат. medialis, от латинского medius — средний), термин в анатомии, указывающий на расположение какой-либо части тела организма ближе к его срединной (медианной) плоскости. Ср. Латеральный .
Медиана (в геометрии)
Медиа'на(от латинского mediana — средняя) в геометрии, отрезок, соединяющий одну из вершин треугольника с серединой противоположной стороны. Три М. треугольника пересекаются в одной точке, которую иногда называют «центром тяжести» треугольника, так как именно в этой точке находится центр тяжести однородной треугольной пластинки (а также центр тяжести системы трёх равных масс, помещенных в вершинах треугольника). Точка пересечения М. делит каждую из них в отношении 2 : 1 (считая от вершины к основанию).
Медиана (в теории вероятностей)
Медиа'нав теории вероятностей, одна из характеристик распределения значений случайной величины . Для случайной величины Х с непрерывной функцией распределения F ( x ) медиана m определяется как корень уравнения
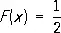
(см. также Квантиль ). Случайная величина Х принимает с вероятностью 1/2 как значения, бо'льшие m , так и значения, меньшие m .
В математической статистике М. вариационного ряда из n величин х 1 £ x 2 £ ... £ x n называют либо x k , если n нечётное и равно 2 k + 1, либо ( x k + x k+1 )/2 при n чётном и равном 2 k . В качестве оценки М. по независимым наблюдениям случайной величины Х принимают М. вариационного ряда, составленного из результатов наблюдений.
Читать дальшеИнтервал:
Закладка:
