БСЭ БСЭ - Большая Советская Энциклопедия (МЕ)
- Название:Большая Советская Энциклопедия (МЕ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (МЕ) краткое содержание
Большая Советская Энциклопедия (МЕ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Соч.: Пути и поиски. [Предисловие Ф. Кузнецова], М., 1970.
Лит.: Абрамов Ф., Люди колхозной деревни в послевоенной прозе, «Новый мир», 1954, № 4; Кузнецов Ф., «Преступление Антона Шелестова», [Рец.], «Литературная газета», 1960, 20 февраля; Атаров Н., За книгой — люди, «Известия», 1969, 28 марта; Русские советские писатели-прозаики. Биобиблиографический указатель, т. 3, Л., 1964.
И. Попова.
Медынь
Меды'нь(в древности Мезецк, или Мядынь), город, центр Медынского района Калужской области РСФСР. Расположен на реке Медынка (бассейн Оки), на шоссе в 14 км от железнодорожной станции Мятлевская (на линии Калуга — Вязьма) и в 62 км к северо-западу от Калуги. Мебельный комбинат, молочный завод, льнозавод, производство стройматериалов и швейных изделий. Точное время основания города неизвестно. М. имела своих князей, а также принадлежала княжеству Смоленскому, от которого в 1386 перешла к Московскому. В 1389 Дмитрий Донской отдал М. (в составе Можайского удела) своему сыну Андрею. В 1454 М. вместе с Можайским уделом присоединена к Москве. В 1472 М. стала собственностью великого князя Василия III, который в 1508 пожаловал её князю Василию Глинскому. При Иване Грозном М. зачислена в опричнину. В 17 веке подверглась разорению. В 1770 — уездный город Калужского наместничества. Во время Отечественной войны 1812 казачий отряд А. В. Иловайского разбил 13 октября (на следующий день после сражения при Малоярославце) под М. авангард французского корпуса Ю. Понятовского, после чего Наполеон принял окончательное решение отступать из Москвы по старой Смоленской дороге, уже опустошённой французскими войсками. С 12 октября 1941 по 14 января 1942 М. была оккупирована немецко-фашистскими захватчиками.
Медь
Медь(лат. Cuprum), Cu, химический элемент I группы периодической системы Менделеева; атомный номер 29, атомная масса 63,546; мягкий, ковкий металл красного цвета. Природная М. состоит из смеси двух стабильных изотопов — 63Cu (69,1 % ) и 65Cu (30,9 % ).
Историческая справка.М. относится к числу металлов, известных с глубокой древности. Раннему знакомству человека с М. способствовало то, что она встречается в природе в свободном состоянии в виде самородков (см. Медь самородная ), которые иногда достигают значительных размеров. М. и её сплавы сыграли большую роль в развитии материальной культуры (см. Бронзовый век ). Благодаря лёгкой восстановимости окислов и карбонатов М. была, по-видимому, первым металлом, который человек научился восстановлять из кислородных соединений, содержащихся в рудах. Латинское название М. происходит от названия острова Кипр, где древние греки добывали медную руду. В древности для обработки скальной породы её нагревали на костре и быстро охлаждали, причём порода растрескивалась. Уже в этих условиях были возможны процессы восстановления. В дальнейшем восстановление вели в кострах с большим количеством угля и с вдуванием воздуха посредством труб и мехов. Костры окружали стенками, которые постепенно повышались, что привело к созданию шахтной печи. Позднее методы восстановления уступили место окислительной плавке сульфидных медных руд с получением промежуточных продуктов — штейна (сплава сульфидов), в котором концентрируется М., и шлака (сплава окислов).
Распространение в природе.Среднее содержание М. в земной коре (кларк) 4,7·10 -3% (по массе), в нижней части земной коры, сложенной основными породами, её больше (1·10 -2%), чем в верхней (2·10 -3%), где преобладают граниты и другие кислые изверженные породы. М. энергично мигрирует как в горячих водах глубин, так и в холодных растворах биосферы; сероводород осаждает из природных вод различные сульфиды М., имеющие большое промышленное значение. Среди многочисленных минералов М. преобладают сульфиды, фосфаты, сульфаты, хлориды, известны также самородная М., карбонаты и окислы.
М. — важный элемент жизни, она участвует во многих физиологических процессах. Среднее содержание М. в живом веществе 2·10 -4%, известны организмы — концентраторы М. В таёжных и других ландшафтах влажного климата М. сравнительно легко выщелачивается из кислых почв, здесь местами наблюдается дефицит М. и связанные с ним болезни растений и животных (особенно на песках и торфяниках). В степях и пустынях (с характерными для них слабощелочными растворами) М. малоподвижна; на участках месторождений М. наблюдается её избыток в почвах и растениях, отчего болеют домашние животные.
В речной воде очень мало М., 1·10 -7%. Приносимая в океан со стоком М. сравнительно быстро переходит в морские илы. Поэтому глины и сланцы несколько обогащены М. (5,7·10 -3% ), а морская вода резко недосыщена М. (3·10 -7%).
В морях прошлых геологических эпох местами происходило значительное накопление М. в илах, приведшее к образованию месторождений (например, Мансфельд в ГДР). М. энергично мигрирует и в подземных водах биосферы, с этими процессами связано накопление руд М. в песчаниках.
Физические и химические свойства.Цвет М. красный, в изломе розовый, при просвечивании в тонких слоях зеленовато-голубой. Металл имеет гранецентрированную кубическую решётку с параметром а = 3,6074 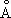 ; плотность 8,96 г/см 3 (20 °С). Атомный радиус 1,28
; плотность 8,96 г/см 3 (20 °С). Атомный радиус 1,28 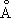 ; ионные радиусы Cu +0,98
; ионные радиусы Cu +0,98 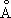 ; Cu 2+0,80
; Cu 2+0,80 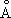 ; t пл.1083 °С; t кип.2600 °С; удельная теплоёмкость (при 20 °С) 385,48 дж /( кг·К ) , то есть 0,092 кал /( г· °С). Наиболее важные и широко используемые свойства М.: высокая теплопроводность — при 20 °С 394,279 вт /( м·К ) , то есть 0,941 кал /( см·сек· °С); малое электрическое сопротивление — при 20 °С 1,68·10 -8 ом·м . Термический коэффициент линейного расширения 17,0·10 -6. Давление паров над М. ничтожно, давление 133,322 н/м 2 (то есть 1 мм рт. ст. ) достигается лишь при 1628 °С. М. диамагнитна; атомная магнитная восприимчивость 5,27·10 -6. Твёрдость М. по Бринеллю 350 Мн/м 2 (то есть 35 кгс/мм 2 ); предел прочности при растяжении 220 Мн/м 2 (то есть 22 кгс/мм 2 ); относительное удлинение 60 %, модуль упругости 132·10 3 Мн/м 2 (то есть 13,2·10 3 кгс/мм 2 ). Путём наклёпа предел прочности может быть повышен до 400—450 Мн/м 2 , при этом удлинение уменьшается до 2 %, а электропроводность уменьшается на 1—3 %. Отжиг наклёпанной М. следует проводить при 600—700 °С. Небольшие примеси Bi (тысячные доли % ) и Pb (сотые доли % ) делают М. красноломкой, а примесь S вызывает хрупкость на холоде.
; t пл.1083 °С; t кип.2600 °С; удельная теплоёмкость (при 20 °С) 385,48 дж /( кг·К ) , то есть 0,092 кал /( г· °С). Наиболее важные и широко используемые свойства М.: высокая теплопроводность — при 20 °С 394,279 вт /( м·К ) , то есть 0,941 кал /( см·сек· °С); малое электрическое сопротивление — при 20 °С 1,68·10 -8 ом·м . Термический коэффициент линейного расширения 17,0·10 -6. Давление паров над М. ничтожно, давление 133,322 н/м 2 (то есть 1 мм рт. ст. ) достигается лишь при 1628 °С. М. диамагнитна; атомная магнитная восприимчивость 5,27·10 -6. Твёрдость М. по Бринеллю 350 Мн/м 2 (то есть 35 кгс/мм 2 ); предел прочности при растяжении 220 Мн/м 2 (то есть 22 кгс/мм 2 ); относительное удлинение 60 %, модуль упругости 132·10 3 Мн/м 2 (то есть 13,2·10 3 кгс/мм 2 ). Путём наклёпа предел прочности может быть повышен до 400—450 Мн/м 2 , при этом удлинение уменьшается до 2 %, а электропроводность уменьшается на 1—3 %. Отжиг наклёпанной М. следует проводить при 600—700 °С. Небольшие примеси Bi (тысячные доли % ) и Pb (сотые доли % ) делают М. красноломкой, а примесь S вызывает хрупкость на холоде.
По химическим свойствам М. занимает промежуточное положение между элементами первой триады VIII группы и щелочными элементами I группы системы Менделеева. М., как и Fe, Со, Ni, склонна к комплексообразованию, даёт окрашенные соединения, нерастворимые сульфиды и т. д. Сходство с щелочными металлами незначительно. Так, М. образует ряд одновалентных соединений, однако для неё более характерно 2-валентное состояние. Соли одновалентной М. в воде практически нерастворимы и легко окисляются до соединений 2-валентной М.; соли 2-валентной М., напротив, хорошо растворимы в воде и в разбавленных растворах полностью диссоциированы. Гидратированные ионы Cu 2+окрашены в голубой цвет. Известны также соединения, в которых М. 3-валентна. Так, действием перекиси натрия на раствор куприта натрия Na 2CuO 2получен окисел Cu 2O 3— красный порошок, начинающий отдавать кислород уже при 100 °С. Cu 2O 3— сильный окислитель (например, выделяет хлор из соляной кислоты).
Читать дальшеИнтервал:
Закладка:
