БСЭ БСЭ - Большая Советская Энциклопедия (МЫ)
- Название:Большая Советская Энциклопедия (МЫ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (МЫ) краткое содержание
Большая Советская Энциклопедия (МЫ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Лит.: Энгельгардт В. А., Ферментативные и механические свойства белков мышц, «Успехи современной биологии», 1941, т. 14, в. 2; Сент-Джиордьи А., О мышечной деятельности, пер. с англ., М., 1947; Иванов И. И., Юрьев В. А., Биохимия и патобиохимия мышц, Л., 1961; Поглазов Б. Ф., Структура и функции сократительных белков, М., 1965; Хайаши Т., Как клетки движутся, в кн.: Живая клетка, пер. с англ., 2 изд., М., 1966; Хаксли Г., Механизм мышечного сокращения, в сб.: Молекулы и клетки, пер. с англ., в. 2, М., 1967; Смит Д., Летательные мышцы насекомых, там же; Бендолл Дж., Мышцы, молекулы и движение, пер. с англ., М., 1970; Арронет Н. И., Мышечные и клеточные сократительные (двигательные) модели, Л., 1971; Лёви А., Сикевиц Ф., Структура и функции клетки, пер. с англ., М., 1971; Иванов И. И., Некоторые актуальные проблемы эволюционной биохимии мышц, «Журнал эволюционной биохимии и физиологии» 1972, т. 8, № 3; Gibbons I. R., The biochemistry of motility, «Annual Review of Biochemistry», 1968, v. 37, р. 521.
И. И. Иванов.

Рис. 4. Электронная микрофотография гладкомышечного волокна. Видны актиновые нити (показаны стрелками).
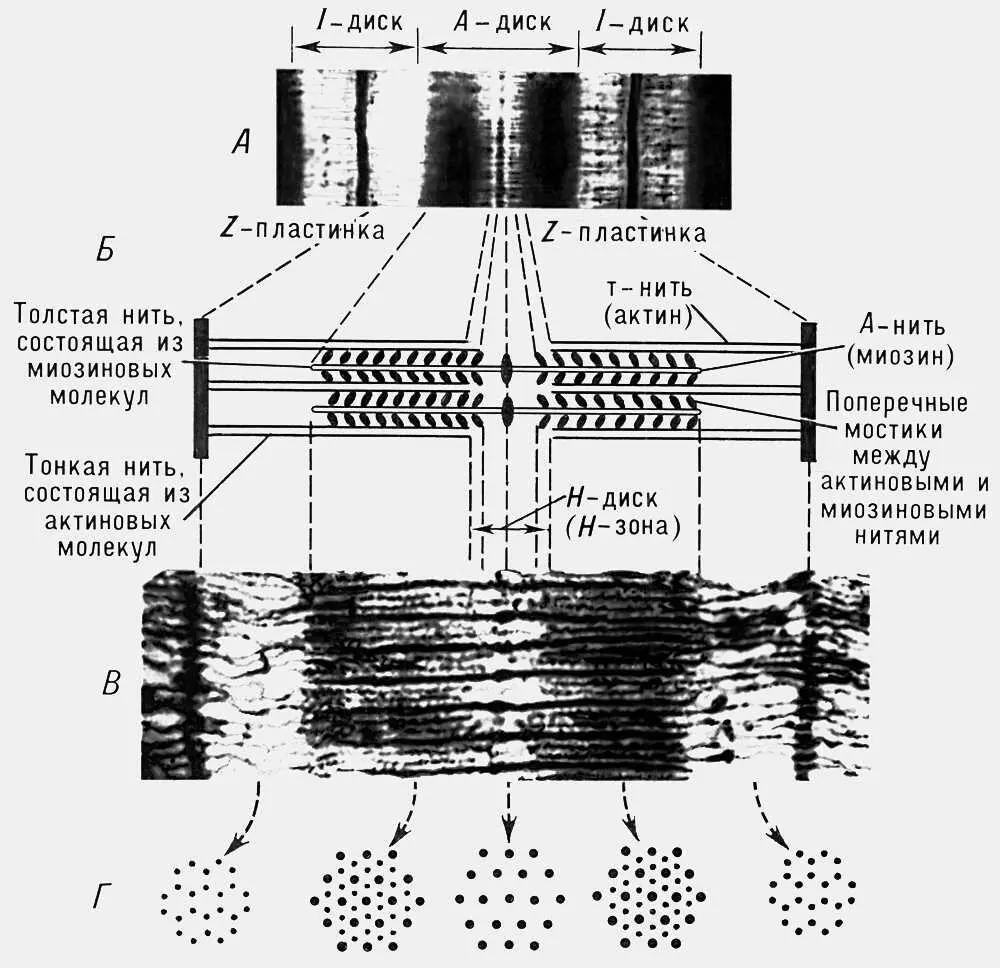
Рис. 3. Строение саркомера поперечнополосатого мышечного волокна: А — электронная микрофотография (малое увеличение), на которой четко видна структура саркомера; Б — схема саркомера; В — электронная микрофотография с высокой разрешающей способностью; Г — поперечное сечение саркомера на различных уровнях, видно положение толстых и тонких нитей в различных участках покоящегося саркомера (по Х. Хаксли).
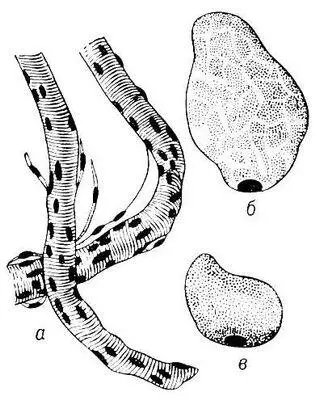
Рис. 1. Поперечнополосатые мышечные волокна человека: а — отрезки двух волокон; б — поперечный разрез волокна, миофибриллы образуют скопления, разграниченные саркоплазмой; в — поперечный разрез волокна с равномерным распределением миофибрилл.
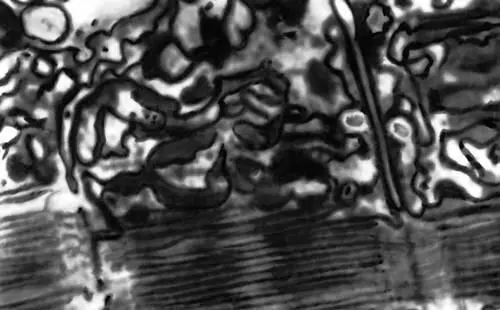
Рис. 2. Электронная микрофотография саркоплазматической сети и Т-системы мышечного волокна.
Мышьяк
Мышья'к(лат. Arsenicum), As, химический элемент V группы периодической системы Менделеева, атомный номер 33, атомная масса 74,9216; кристаллы серо-стального цвета. Элемент состоит из одного устойчивого изотопа 75As.
Историческая справка. Природные соединения М. с серой (аурипигмент As 2S 3, реальгар As 4S 4) были известны народам древнего мира, которые применяли эти минералы как лекарства и краски. Был известен и продукт обжигания сульфидов М. — оксид М. (III) As 2O 3(«белый М.»). Название arsenikón встречается уже у Аристотеля; оно произведено от греч. ársen — сильный, мужественный и служило для обозначения соединений М. (по их сильному действию на организм). Русское название, как полагают, произошло от «мышь» (по применению препаратов М. для истребления мышей и крыс). Получение М. в свободном состоянии приписывают Альберту Великому (около 1250). В 1789 А. Лавуазье включил М. в список химических элементов.
Распространение в природе. Среднее содержание М. в земной коре (кларк) 1,7·10 -4% (по массе), в таких количествах он присутствует в большинстве изверженных пород. Поскольку соединения М. летучи при высоких температурах, элемент не накапливается при магматических процессах; он концентрируется, осаждаясь из горячих глубинных вод (вместе с S, Se, Sb, Fe, Co, Ni, Cu и др. элементами). При извержении вулканов М. в виде своих летучих соединений попадает в атмосферу. Так как М. многовалентен, на его миграцию оказывает большое влияние окислительно-восстановительная среда. В окислительных условиях земной поверхности образуются арсенаты (As 5+) и арсениты (As 3+). Это редкие минералы, встречающиеся только на участках месторождений М. Ещё реже встречается самородный М. и минералы As 2+. Из многочисленных минералов М. (около 180) основное промышленное значение имеет лишь арсенопирит FeAsS (см. Мышьяковые руды ).
Малые количества М. необходимы для жизни. Однако в районах месторождении М. и деятельности молодых вулканов почвы местами содержат до 1% М., с чем связаны болезни скота, гибель растительности. Накопление М. особенно характерно для ландшафтов степей и пустынь, в почвах которых М. малоподвижен. Во влажном климате М. легко вымывается из почв.
В живом веществе в среднем 3·10 -5% М., в реках 3·10 -7%. М., приносимый реками в океан, сравнительно быстро осаждается. В морской воде лишь 1·10 -7% М., но зато в глинах и сланцах 6,6·10 -4%. Осадочные железные руды, железомарганцевые конкреции часто обогащены М.
Физические и химические свойства. М. имеет несколько аллотропических модификаций. При обычных условиях наиболее устойчив так называемый металлический, или серый, М. (a-As) — серо-стальная хрупкая кристаллическая масса; в свежем изломе имеет металлический блеск, на воздухе быстро тускнеет, т. к. покрывается тонкой плёнкой As 2O 3. Кристаллическая решётка серого М. ромбоэдрическая ( а = 4,123 Å, угол a = 54°10', х = 0,226), слоистая. Плотность 5,72 г/см 3 (при 20°C), удельное электрическое сопротивление 35·10 -8 ом × м , или 35·10 -6 ом × см , температурный коэффициент электросопротивления 3,9·10 -3(0°—100 °C), твёрдость по Бринеллю 1470 Мн/м 2 , или 147 кгс/мм 2 (3—4 по Моосу); М. диамагнитен. Под атмосферным давлением М. возгоняется при 615 °C не плавясь, т. к. тройная точка (см. Диаграмма состояния ) a-As лежит при 816 °C и давлении 36 ат . Пар М. состоит до 800 °C из молекул As 4, выше 1700 °C — только из As 2. При конденсации пара М. на поверхности, охлаждаемой жидким воздухом, образуется жёлтый М. — прозрачные, мягкие как воск кристаллы, плотностью 1,97 г/см 3 , похожие по свойствам на белый фосфор . При действии света или при слабом нагревании он переходит в серый М. Известны также стекловидно-аморфные модификации: чёрный М. и бурый М., которые при нагревании выше 270°C превращаются в серый М.
Конфигурация внешних электронов атома М. 3 d 104 s 24 p 3. В соединениях М. имеет степени окисления + 5, + 3 и – 3. Серый М. значительно менее активен химически, чем фосфор. При нагревании на воздухе выше 400°C М. горит, образуя As 2O 3. С галогенами М. соединяется непосредственно; при обычных условиях AsF 5— газ; AsF 3, AsCl 3, AsBr 3— бесцветные легко летучие жидкости; AsI 3и As 2l 4— красные кристаллы. При нагревании М. с серой получены сульфиды: оранжево-красный As 4S 4и лимонно-жёлтый As 2S 3. Бледно-жёлтый сульфид As 2S 5осаждается при пропускании H 2S в охлаждаемый льдом раствор мышьяковой кислоты (или её солей) в дымящей соляной кислоте: 2H 3AsO 4+ 5H 2S = As 2S 5+ 8H 2O; около 500°C он разлагается на As 2S 3и серу. Все сульфиды М. нерастворимы в воде и разбавленных кислотах. Сильные окислители (смеси HNO 3+ HCl, HCl + KClO 3) переводят их в смесь H 3AsO 4и H 2SO 4. Сульфид As 2S 3легко растворяется в сульфидах и полисульфидах аммония и щелочных металлов, образуя соли кислот — тиомышьяковистой H 3AsS 3и тиомышьяковой H 3AsS 4. С кислородом М. даёт окислы: оксид М. (III) As 2O 3— мышьяковистый ангидрид и оксид М. (V) As 2O 5— мышьяковый ангидрид. Первый из них образуется при действии кислорода на М. или его сульфиды, например 2As 2S 3+ 9O 2= 2As 2O 3+ 6SO 2. Пары As 2O 3конденсируются в бесцветную стекловидную массу, которая с течением времени становится непрозрачной вследствие образования мелких кристаллов кубической сингонии, плотность 3,865 г/см 3 . Плотность пара отвечает формуле As 4O 6: выше 1800°C пар состоит из As 2O 3. В 100 г воды растворяется 2,1 г As 2O 3(при 25°C). Оксид М. (III) — соединение амфотерное, с преобладанием кислотных свойств. Известны соли (арсениты), отвечающие кислотам ортомышьяковистой H 3AsO 3и метамышьяковистой HAsO 2; сами же кислоты не получены. В воде растворимы только арсениты щелочных металлов и аммония. As 2O 3и арсениты обычно бывают восстановителями (например, As 2O 3+ 2I 2+ 5H 2O = 4HI + 2H 3AsO 4), но могут быть и окислителями (например, As 2O 3+ 3C = 2As + 3CO).
Читать дальшеИнтервал:
Закладка:
