БСЭ БСЭ - Большая Советская Энциклопедия (НИ)
- Название:Большая Советская Энциклопедия (НИ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (НИ) краткое содержание
Большая Советская Энциклопедия (НИ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Нитропарафины
Нитропарафи'ны, см. в ст. Нитросоединения .
Нитросоединения
Нитросоедине'ния, органические соединения, содержащие одну или несколько нитрогрупп — NO 2в молекуле, связанных с атомами углерода. Различают моно-, ди-, три- и полинитросоединения (поли-Н.). Н. могут быть алифатическими (нитропарафины и нитроолефины); ароматическими, содержащими нитрогруппы в ароматическом ядре, например нитроанилины , нитробензол , нитротолуолы , нитронафталины и др.; жирноароматическими — Н. с нитрогруппами только в боковой алифатической цепи, например фенилнитрометан С 6Н 5СН 2NO 2, нитростирол C 6H 5CH = CHNO 2и др., а также Н. с нитрогруппами в боковой цепи и ароматическом кольце, например n -нитрофенилнитрометан O 2NC 6H 4CH 2NO 2.
Ароматические Н. — желтоватые жидкости или кристаллические вещества, хорошо растворимые в органических растворителях, плохо — в воде; их синтезируют в промышленности и лабораторных условиях нитрованием ароматических соединений нитрующими смесями . Ароматические поли-Н. применяются в качестве взрывчатых веществ [ тринитротолуол , аммониевая соль тринитрофенола (см. Пикраты ), тринитрофенилметилнитрамин и др.]. Восстановление нитрогрупп приводит к ароматическим аминам — полупродуктам в производстве различных красителей.
Алифатические Н. получают в промышленности главным образом нитрованием парафинов азотной кислотой или окислами азота. Простейшие мононитропарафины — бесцветные жидкости со своеобразным запахом. Нитро-парафины легко восстанавливаются до гидроксиламинов и аминов. При действии оснований первичные и вторичные Н. образуют соли аци-формы нитросоединений, т. н. изонитросоединений (I), легко превращающиеся в альдегиды или кетоны (II):
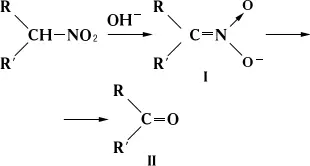
(R — алкил, R' — H или алкил).
При обработке солей Н. (III), а в некоторых случаях самих Н. или их аци-форм алкилирующими агентами может происходить О-алкилирование с образованием нитроновых эфиров (IV):
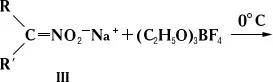
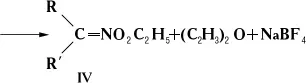
или С-алкилирование:
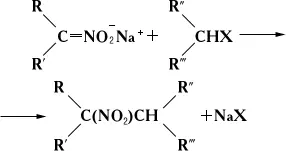
(X — атом галогена). Направление реакции зависит как от структуры соли, так и от природы алкилирующего агента. При действии на Н. концентрированных кислот получаются карбоновые кислоты. Алифатические Н. легко конденсируются с альдегидами и кетонами с образованием нитроспиртов, дегидратация которых приводит к нитроолефинам. Эти реакции широко используют в лабораторной практике. Нитропарафины хорошо растворяют различные органические соединения. См. также Нитрометан , Нитроформ , Тетранитрометан .
Некоторые Н. обладают токсическим действием, могут вызывать поражение печени, иногда глаз (катаракта).
Лит.: Химия нитро- и нитрозогрупп, под ред. Г. Фойера, пер. с англ., М., 1972; Топчиев А. В., Нитрование углеводородов и других органических соединений, 2 изд., М., 1956; Орлова Е. Ю., Химия и технология бризантных взрывчатых веществ, 2 изд., Л., 1973.
М. М. Краюшкин.
Нитротолуолы
Нитротолуо'лы, продукты замещения атомов водорода в ядре толуола С бН 5СН 3нитрогруппами —NO 2. Техническое значение имеют Н., приведённые в таблице.
| Нитротолуолы | t пл, °C | Ткип , °C | Плотность, г/см 3 ( t , °C) |
| о -Нитротолуол м -Нитротолуол n -Нитротолуол 2,4-Динитротолуол 2,4,6-Тринитротолуол | —9,27 (b) —3,17 (a) 16,1 51,6—52,1 69,5—70,5 80,8 | 221,7 232,6 237,7 — Взрывается при280 ° C | 1,162 (19) 1,157 (20) 1,123 (55) 1,521 (15) 1,55—1,6 |
Мононитротолуолы в виде смеси изомеров (56% орто , 38% мета и 4% пара) получают нитрованием толуола нитрующей смесью ; о -Н. и м - Н. — светло-жёлтые жидкости, пара -изомер — бесцветное кристаллическое вещество; применяют для получения толуидинов — полупродуктов в производстве азокрасителей и сернистых красителей . Динитротолуол получают нитрованием главным образом технической смеси мононитротолуолов; полученный продукт — кристаллическое вещество жёлтого цвета, температура затвердевания 50—54 °C — содержит в основном 2,4-изомер; обладает взрывчатыми свойствами, применяют для получения диизоцианатов — исходных веществ для синтеза полиуретанов . 2,4,6 - Тринитротолуол (тротил) — мощное взрывчатое вещество. Н. ядовиты; предельно допустимая концентрация, например, 2,4-динитротолуола, в воздухе рабочих помещений 1 мг/м 3.
Лит.: Орлова Е. Ю., Химия и технология бризантных взрывчатых веществ, 2 изд., Л., 1973; Ворожцов Н. Н., Основы синтеза промежуточных продуктов и красителей, 4 изд., М. 1955.
Нитрофенолы
Нитрофено'лы, продукты замещения атомов водорода в ядре фенола С бН 5ОН нитрогруппами — NO 2. Техническое значение имеют Н., приведённые в таблице.
| Нитрофенолы | t пл, °C | Плотность, г/см 3 ( t пл, °C) |
| о -Нитрофенол n -Нитрофенол 2,4-Динитрофенол 2,4,6-Тринирофенол | 44,9 114 113 122,5 | 1,29 (40) 1,48 (20) 1,68 (24) 1,76 (20) |
Н. — кристаллические вещества. Мононитрофенолы ( о -Н. и n -Н.) в промышленности получают нагреванием соответствующих нитрохлорбензолов с водным раствором NaOH, 2,4-динитрофенол (2,4-Д.) — аналогично из 2,4-динитрохлорбензола. Эти Н. — кровяные яды, действуют также на нервную систему, раздражают слизистые оболочки, кожу, вызывая дерматиты и хронические экземы. Предельно допустимая концентрация, например, 2,4-Д. в воздухе рабочих помещений 0,05 мг/м 3. о -Н. и n -Н. применяют главным образом для получения о - и n- аминофенолов . Из 2,4-динитрофенола получают пикриновую кислоту, краситель сернистый чёрный, 2,4-диаминофенол (проявитель амидол ); его используют также в качестве гербицида.
2,4,6-Тринитрофенол (2,4,6-Т.), или пикриновая кислота, использовался как жёлтый краситель для шёлка (первый искусственный органический краситель) и как взрывчатое вещество (мелинит, лиддит); ядовит, предельно допустимая концентрация в воздухе рабочих помещений 1 мг/м 3. С металлами 2,4,6-Т. образует взрывоопасные легковоспламеняющиеся соли — пикраты .
Лит.: Орлова Е. Ю., Химия и технолог гия бризантных взрывчатых веществ, 2 изд., Л., 1973.
Д. А. Гуревич.
Нитрофильные растения
Интервал:
Закладка:
