БСЭ БСЭ - Большая Советская Энциклопедия (НИ)
- Название:Большая Советская Энциклопедия (НИ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (НИ) краткое содержание
Большая Советская Энциклопедия (НИ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Н. используется, например, для покрытия деталей химической аппаратуры, автомобилей, велосипедов, медицинского инструмента, приборов, предметов домашнего обихода, измерительного инструмента, клише, стереотипов, а также деталей, эксплуатируемых с небольшими нагрузками в условиях сухого трения, и т.д. Никелевые покрытия с течением времени несколько теряют свой первоначальный блеск. Поэтому часто слой никеля покрывают более стойким слоем хрома (см. Хромирование ) .
Лит.: Ямпольский А. М., Современная технология никелирования, Л., 1950; Горбунова К. М., Никифорова А. А., Физико-химические основы процесса химического никелирования, М., 1960; Лайнер В. И., Современная гальванотехника, М., 1967.
Л. Л. Жуков.
Никель (пос. гор. типа в Мурманской обл.)
Ни'кель,посёлок городского типа, центр Печенгского района Мурманской области РСФСР. Расположен у озера Куэтс-Ярви. Ж.-д. станция в 196 км к С.-З. от Мурманска. 18,8 тыс. жителей (1973). Горно-металлургический комбинат «Печенганикель».
Никель (хим. элемент)
Ни'кель(лат. Niccolum), Ni, химический элемент первой триады VIII группы периодической системы Менделеева, атомный номер 28, атомная масса 58,70; серебристо-белый металл, ковкий и пластичный. Природный Н. состоит из смеси пяти стабильных изотопов: 58Ni (67,76%), 60Ni (26,16%), 61Ni (1,25%), 63Ni (3,66%), 64Ni (1,16%).
Историческая справка. Металл в нечистом виде впервые получил в 1751 шведский химик А. Кронстедт, предложивший и название элемента. Значительно более чистый металл получил в 1804 немецкий химик И. Рихтер. Название «Н.» происходит от минерала купферникеля (NiAs), известного уже в 17 в. и часто вводившего в заблуждение горняков внешним сходством с медными рудами (нем. Kupfer — медь, Nickel — горный дух, якобы подсовывавший горнякам вместо руды пустую породу). С середины 18 в. Н. применялся лишь как составная часть сплавов, по внешности похожих на серебро. Широкое развитие никелевой промышленности в конце 19 в. связано с нахождением крупных месторождений никелевых руд в Новой Каледонии и в Канаде и открытием «облагораживающего» его влияния на свойства сталей.
Распространение в природе. Н. — элемент земных глубин (в ультраосновных породах мантии его 0,2% по массе). Существует гипотеза, что земное ядро состоит из никелистого железа; в соответствии с этим среднее содержание Н. в земле в целом по оценке около 3%. В земной коре, где Н. 5,8×10 -3%, он также тяготеет к более глубокой, так называемой базальтовой оболочке. Ni в земной коре — спутник Fe и Mg, что объясняется сходством их валентности (II) и ионных радиусов; в минералы двухвалентных железа и магния Н. входит в виде изоморфной примеси. Собственных минералов Н. известно 53; большинство из них образовалось при высоких температурах и давлениях, при застывании магмы или из горячих водных растворов. Месторождения Н. связаны с процессами в магме и коре выветривания. Промышленные месторождения Н. (сульфидные руды) обычно сложены минералами Н. и меди (см. Никелевые руды ) . На земной поверхности, в биосфере Н. — сравнительно слабый мигрант. Его относительно мало в поверхностных водах, в живом веществе. В районах, где преобладают ультраосновные породы, почва и растения обогащены никелем.
Физические и химические свойства. При обычных условиях Н. существует в виде b-модификации, имеющей гранецентрированную кубическую решётку ( a = 3,5236 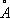 ). Но Н., подвергнутый катодному распылению в атмосфере H 2, образует a-модификацию, имеющую гексагональную решётку плотнейшей упаковки ( а = 2,65
). Но Н., подвергнутый катодному распылению в атмосфере H 2, образует a-модификацию, имеющую гексагональную решётку плотнейшей упаковки ( а = 2,65 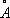 , с = 4,32
, с = 4,32 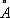 ), которая при нагревании выше 200 °С переходит в кубическую. Компактный кубический Н. имеет плотность 8,9 г/см 3 (20 °С), атомный радиус 1,24
), которая при нагревании выше 200 °С переходит в кубическую. Компактный кубический Н. имеет плотность 8,9 г/см 3 (20 °С), атомный радиус 1,24 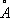 , ионные радиусы: Ni 2+0,79
, ионные радиусы: Ni 2+0,79 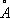 , Ni 3+0,72
, Ni 3+0,72 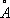 ; t пл 1453 °С; t kип около 3000 °С; удельная теплоёмкость при 20 °С 0,440 кдж/ ( кг·К ) [0,105 кал/ ( г °С)]; температурный коэффициент линейного расширения 13,310 -6(0—100 °С); теплопроводность при 25 °С 90,1 вмl ( м·K ) [0,215 кал/ ( см·сек· оС)]; то же при 500 °С 60,01 вм/ ( м·К ) [0,148 кал/см ( сек· оС)] . Удельное электросопротивление при 20 °С 68,4 ном·м, т. е. 6,84 мком·см; температурный коэффициент электросопротивления 6,8×10 -3(0—100 °С).
; t пл 1453 °С; t kип около 3000 °С; удельная теплоёмкость при 20 °С 0,440 кдж/ ( кг·К ) [0,105 кал/ ( г °С)]; температурный коэффициент линейного расширения 13,310 -6(0—100 °С); теплопроводность при 25 °С 90,1 вмl ( м·K ) [0,215 кал/ ( см·сек· оС)]; то же при 500 °С 60,01 вм/ ( м·К ) [0,148 кал/см ( сек· оС)] . Удельное электросопротивление при 20 °С 68,4 ном·м, т. е. 6,84 мком·см; температурный коэффициент электросопротивления 6,8×10 -3(0—100 °С).
Н. — ковкий и тягучий металл, из него можно изготовлять тончайшие листы и трубки. Предел прочности при растяжении 400—500 Мн/м 2 (т. е. 40—50 кгс/мм 2 ) , предел упругости 80 Мн/м 2, предел текучести 120 Мн/м 2 ; относительное удлинение 40%; модуль нормальной упругости 205 Гн/м 2; твёрдость по Бринеллю 600—800 Мн/м 2. В температурном интервале от 0 до 631 К (верхняя граница соответствует Кюри точке ) Н. ферромагнитен. Ферромагнетизм Н. обусловлен особенностями строения внешних электронных оболочек (3d 84s 2) его атомов. Н. вместе с Fe (3d 64s 2) и Со (3d 74s 2), также ферромагнетиками, относится к элементам с недостроенной 3d-электронной оболочкой (к переходным 3d-металлам). Электроны недостроенной оболочки создают нескомпенсированный спиновый магнитный момент, эффективное значение которого для атомов Н. составляет 6 m Б, где m Б— Бора магнетон. Положительное значение обменного взаимодействия в кристаллах Н. приводит к параллельной ориентации атомных магнитных моментов, т. е. к ферромагнетизму. По той же причине сплавы и ряд соединений Н. (окислы, галогениды и др.) магнитоупорядочены (обладают ферро-, реже ферримагнитной структурой, см. Магнитная структура ) . Н. входит в состав важнейших магнитных материалов и сплавов с минимальным значением коэффициента теплового расширения ( пермаллой, монель-металл, инвар и др.).
В химическом отношении Ni сходен с Fe и Со, но также и с Cu и благородными металлами. В соединениях проявляет переменную валентность (чаще всего 2-валентен). Н. — металл средней активности, Поглощает (особенно в мелкораздробленном состоянии) большие количества газов (H 2, CO и др.); насыщение Н. газами ухудшает его механические свойства. Взаимодействие с кислородом начинается при 500 °С; в мелкодисперсном состоянии Н. пирофорен — на воздухе самовоспламеняется. Из окислов наиболее важна закись NiO — зеленоватые кристаллы, практически нерастворимые в воде (минерал бунзенит). Гидроокись выпадает из растворов никелевых солей при прибавлении щелочей в виде объёмистого осадка яблочно-зелёного цвета. При нагревании Н. соединяется с галогенами, образуя NiX 2. Сгорая в парах серы, даёт сульфид, близкий по составу к Ni 3S 2. Моносульфид NiS может быть получен нагреванием NiO с серой.
Читать дальшеИнтервал:
Закладка:
