БСЭ БСЭ - Большая Советская Энциклопедия (ПЛ)
- Название:Большая Советская Энциклопедия (ПЛ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ПЛ) краткое содержание
Большая Советская Энциклопедия (ПЛ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
RuO 4+ 2KOH = K 2RuO 4+ 1/ 2O 2+ H 2O.
При действии хлора K 2RuO 4превращается в перрутенат калия:
K 2RuO 4+ 1/ 2Cl 2= KRuO 4+ KCI.
Четырёхокись OsO 4даёт с KOH комплексное соединение K 2[OsO 4(OH) 2]. С фтором и др. галогенами Ru и Os легко реагируют при нагревании, образуя соединения типа RuF 3, RuF 4, RuF 5, RuF 6. Осмий даёт подобные же соединения, кроме OsF 3; существование OsF 8не подтверждено. Весьма интересны комплексные соединения Ru с ксеноном Xe [RuF 6] (канадский химик Н. Бартлетт, 1962), а также с молекулярным азотом — [(NO)(NH 3) 4N 2Ru (NH 3) 4NO] CI (советский химик Н. М. Синицын, 1962) и [Ru (NH 3) 5N 2] Cl 2(канадский химик А. Аллен, 1965).
На компактные Rh и lr царская водка не действует. При прокаливании в O 2 образуются окислы Rh 2O 3и Ir 2O 3, разлагающиеся при высоких температурах.
Pd легко растворяется при нагревании в HNO 3и концентрированной H 2SO 4с образованием нитрата Pd (NO 3) 2и сульфата PdSO 4. На Pt эти кислоты не действуют. Царская водка растворяет Pd и Pt, причём образуются комплексные кислоты — тетрахлоропалладиевая кислота H 2[PdCl 4] и гексахлороплатиновая — коричнево-красные кристаллы состава H 2[PtCl 6]×6H 2O Из её солей наибольшее значение для технологии П. м. имеет хлороплатинат аммония (NH 4) 2[PtCl 6] — светло-жёлтые кристаллы, малорастворимые в воде и почти не растворимые в концентрированных растворах NH 4CI. При прокаливании они разлагаются по реакции:
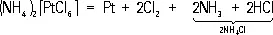
При этом Pt получается в мелкораздробленном виде (т. н. платиновая губка, или губчатая платина).
Получение. Разделение П. м. и получение их в чистом виде очень сложно вследствие большого сходства их химических свойств; это требует большой затраты труда, времени, дорогих реактивов. Для получения чистой Pt исходные материалы — самородную платину, платиновые шлихи (тяжёлые остатки от промывки платиноносных песков), лом (негодные для употребления изделия из Pt и её сплавов) обрабатывают царской водкой при подогревании. В раствор переходят: Pt, Pd, частично Rh, lr в виде комплексных соединений H 2[PtCl 6], H 2[PdCl 4], Н з[RhCl 6] и H 2[IrCl 6], а также Fe и Cu в виде FeCl зи CuCl 2. Нерастворимый в царской водке остаток состоит из осмистого иридия, хромистого железняка (FeCrO 2), кварца и др. минералов.
Из раствора осаждают Pt в виде (NH 4) 2[PtCl 6] хлористым аммонием. Но чтобы в осадок вместе с Pt не выпал lr в виде аналогичного нерастворимого соединения (NH 4) 2[lrCl 6] (остальные П. м. NH 4Cl не осаждает), предварительно восстанавливают Ir (+4) до Ir (+3) (например, прибавлением сахара C 12H 22O 11по способу И. И. Черняева ) . Соединение (NH 4) 3[IrCl 6] растворимо и не загрязняет осадка.
Хлороплатинат аммония отфильтровывают, промывают концентрированным раствором NH 4CI (в котором осадок практически не растворим), высушивают и прокаливают. Полученную губчатую платину спрессовывают, а затем оплавляют в кислородно-водородном пламени или в электрической печи высокой частоты. Из фильтрата, оставшегося после осаждения (NH 4) 2[PtCl 6], и из осмистого иридия извлекают прочие П. м. путём сложных химических операций. В частности, для перевода в растворимое состояние нерастворимых в царской водке П. м. и осмистого иридия используют спекание с перекисями BaO 2или Na 2O 2. Применяют также хлорирование — нагревание смеси Pt-концентратов с NaCl и NaOH в струе хлора.
В результате аффинажа получают труднорастворимые комплексные соединения: гексахлорорутенат аммония (NH 4) 3[RuCl 6], дихлорид тетрамминдиоксоосмия [OsO 2(NH 3) 4] Cl 2, хлорпентамминдихлорид родия [Rh (NH 3) 5CI] Cl 2, гексахлороиридат аммония (NH 4) 2[lrCl 6] и дихлордиаммин палладия [Pd (NH 3) 2] Cl 2. Прокаливанием перечисленных соединений в атмосфере H 2получают П. м. в виде губки, например
[OsO 2(NH 3) 4] Cl 2+ 3H 2= Os + 2H 2O + 4NH 3+ 2HCI
[Pd (NH 3) 2] Cl 2+ H 2= Pd + 2NH 3+ 2HCI.
Губчатые П. м. сплавляют в вакуумной электрической печи высокой частоты.
Применяют и др. способы аффинажа, в частности основанные на использовании ионитов.
Основным источником получения П. м. служат сульфидные медно-никелевые руды, месторождения которых находятся в СССР (Норильск, Красноярский край), Канаде (округ Садбери, провинция Онтарио), ЮАР и др. странах. В результате сложной металлургической переработки этих руд благородные металлы переходят в т. н. черновые металлы — нечистые никель и медь. П. м. собираются почти полностью в черновом Ni, a Ag и Au — в черновой Cu. При последующем электролитическом рафинировании Ag, Au и П. м. осаждаются на дне электролитической ванны в виде шлама, который отправляют на аффинаж.
Свойства платиновых металлов
| Свойство | Ru | Rh | Pd | Os | lr | Pt |
| Атомный номер | 44 | 45 | 46 | 76 | 77 | 78 |
| Атомная масса | 101,07 | 102,9055 | 11906,4 | 190,2 | 192,22 | 195,09 |
| Среднее содержание в земной коре, % по массе | (5·10 -7) | 1·10 -7 | 1·10 -6 | 5·10 -6 | 1·10 -7 | 5·10 -7 |
| Массовые числа природных изотопов (в скобках указано распространение | 96, 98, 99, 100, 101,102 (31, 61), 104 | 103 (100) | 102, 104, 105 (22,23), 106 (27,33), 108 (26,71), 110 (11,8) | 184, 186, 187, 188, 189, 190 (26,4), 192 (41,0) | 191 (38,5) 193 (61,5) | 190, 192 (оба слабо радиоактивны), 194 (32,9), 196(25,2), 198 (7,19) |
Кристаллическая решётка, параметры в  (при 20 °С) (при 20 °С) |
Гексагональ- ная плотнейшей упаковки* a =2,7057 c =4,2815 | Гранецент- рированная кубическая a =3,7957 | Гранецент- рирован- ная кубическая a =3,8824 | Гексаго- нальная плотней- шей упаковки a =2,7533 c =4,3188 | Гране- центри- рованная кубичес- кая a =3,8312 | Гране- центри- рован- ная кубичес- кая a =3,916 |
Атомный радиус, 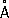 |
1,34 | 1,34 | 1,37 | 1,36 | 1,36 | 1,39 |
Ионный радиус, 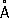 (по Л. Полингу) (по Л. Полингу) |
Ru 4+0,67 | Rh 4+0,68 | Pd 4+0,65 | Os4 +0,65 | lr 4+0,68 | Pt 4+0,65 |
| Конфигурация внешних электронных оболочек | 4d 75s 1 | 4d 85s 1 | 4d 10 | 5d 66s 2 | 5d 76s 2 | 5d 96s 1 |
| Состояния окисления (наиболее характерные набраны полужирным шрифтом) | 1,2, 3,4, 5, 6,7, 8 | 1, 3,4 | 2, 3,4 | 2,3, 4,6,8 | 1,2, 3,4,6 | 2,3, 4 |
| Плотность (при 20 °С), г/см 3 | 12,2 | 12,42 | 11,97 | 22,5 | 22,4 | 21,45 |
| Температура плавления, °С | 2250 | 1960 | 1552 | ок. 3050 | 2410 | 1769 |
| Температура кипения, °С | ок. 4900 | ок. 4500 | ок. 3980 | ок. 5500 | ок. 5300 | ок. 4530 |
| Линейный коэффициент теплового расширения | 9,1×10 -6(20°С) | 8,5×10 -6(0—100 °С) | 11,67×10 -6(0°С) | 4,6×10 -6° | 6,5×10 -6(0—100°С) | 8,9×10 -6(0°С) |
| Теплоёмкость, кал/( г ×°С) | 0,057 (0°C) | 0,059 (20 °C) | 0,058 (0°С) | 0,0309 (°С) | 0,0312 | 0,0314 (0°С) |
| кдж/ ( кг × К. ) | 0,0312 | 0,247 | 0,243 | 0,129 | 0,131 | 0,131 |
| Теплопроводность кал/ ( см × сек °С) | — | 0,36 | 0,17 | — | — | 0,17 |
| вт/ ( м ×К) | — | 151 | 71 | — | — | 71 |
| Удельное электросопротивление, ом × см ×10 -6 (или ом × см ×10 -8) | 7,16-7,6 (0°C) | 4,7 (0°C) | 10,0 (0°C) | 9,5 (0°C) | 5,40 (25°C) | 9,81 (0°C) |
| Температурный коэффициент электросопротивления | 44,9×10 -4(0—100°C) | 45,7×10 -4(0—100°C) | 37,7×10 -4(0—100°C) | 42×10 -4(0—100°C) | 39,25×10 -4(0—100°C) | 39,23×10 -4(0—100°C) |
| Модуль нормальной упругости, кгс/мм 2** | 47200 | 32000 | 12600 | 58000 | 52000 | 17330 |
| Твёрдость по Бринеллю, кгсlмм 2 | 220 | 139 | 49 | 400 | 164 | 47 |
| Предел прочности при растяжении, кгс/мм 2 | — | 48 | 18,5 | — | 23 | 14,3 |
| Относительное удлинение при разрыве, % | — | 15 | 24—30 | — | 2 | 31 |
*Для Ru обнаружены полиморфные превращения при температурах 1035, 1190 и 1500°С.
Читать дальшеИнтервал:
Закладка:
