БСЭ БСЭ - Большая Советская Энциклопедия (СВ)
- Название:Большая Советская Энциклопедия (СВ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (СВ) краткое содержание
Большая Советская Энциклопедия (СВ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
В состав помещений вспомогательного назначения входят: помещения для хранения инвентаря, подстилки (если она применяется), для обслуживающего персонала, площадка для взвешивания животных. В репродукционном здании-блоке или в специализированном свинарнике-хрячнике предусматривается также пункт искусственного осеменения с манежем, лабораторией, моечной, станковым помещением для осеменённых животных.
С., как правило, оборудуют водопроводом, вентиляцией, отоплением, канализацией, обеспечивают электрическим освещением. В осенне-зимний период в целях стимуляции роста поросят-сосунов и отъёмышей применяют искусственное облучение их ультрафиолетовыми лучами. Для механизации и автоматизации производственных процессов (кормления, поения, уборки навоза и др.) в С. используют специальное оборудование или системы машин и механизмов (автокормушки, автопоилки, гидросмыв навоза и др.).
В связи с переходом на новую технологию производства свинины на промышленной основе во многих районах строят крупные свиноводческие комплексы (см. Комплексы животноводческие ) .
Лит.: Справочник зоотехника, 3 изд., ч. 1, М., 1969; Справочник по механизации работ на животноводческих фермах, под ред. Н. И. Мжельского, Л., 1972; Краткий зоотехнический справочник, М., 1975.
Б. И. Никандров.
Свинец
Свине'ц(лат. Plumbum), Pb, химический элемент IV группы периодической системы Менделеева; атомный номер 82, атомная масса 207,2. С. — тяжёлый металл голубовато-серого цвета, очень пластичный, мягкий (режется ножом, царапается ногтем). Природный С. состоит из 5 стабильных изотопов с массовыми числами 202 (следы), 204 (1,5%), 206 (23,6%), 207 (22,6%), 208 (52,3%). Последние три изотопа — конечные продукты радиоактивных превращений 238U, 235U и 232Th (см. Радиоактивные ряды ) . При ядерных реакциях образуются многочисленные радиоактивные изотопы С. Историческая справка. С. был известен за 6—7 тыс. лет до н. э. народам Месопотамии, Египта и других стран древнего мира. Он служил для изготовления статуй, предметов домашнего обихода, табличек для письма. Римляне пользовались свинцовыми трубами для водопроводов. Алхимики называли С. сатурном и обозначали его знаком этой планеты (см. Знаки химические ) . Соединения С. — «свинцовая зола» PbO, свинцовые белила 2PbCO 3•Pb (OH) 2применялись в Древней Греции и Риме как составные части лекарств и красок. Когда было изобретено огнестрельное оружие, С. начали применять как материал для пуль. Ядовитость С. отметили ещё в 1 в. н. э. греческий врач Диоскорид и Плиний Старший, Распространение в природе. Содержание С. в земной коре (кларк) 1,6·10 -3% по массе. Образование в земной коре около 80 минералов, содержащих С. (главный из них галенит PbS), связано в основном с формированием гидротермальных месторождений (см. Полиметаллические руды ) . В зонах окисления полиметаллических руд образуются многочисленные (около 90) вторичные минералы: сульфаты (англезит PbSO 4), карбонаты (церуссит PbCO 3), фосфаты [пироморфит Pb 5(PO 4) 3Cl]. В биосфере С. в основном рассеивается, его мало в живом веществе (5·10 -5%), морской воде (3·10 -9%). Из природных вод С. отчасти сорбируется глинами и осаждается сероводородом, поэтому он накапливается в морских илах с сероводородным заражением и в образовавшихся из них чёрных глинах и сланцах, Физические и химические свойства. С. кристаллизуется в гранецентрированной кубической решётке ( а = 4,9389 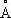 ), аллотропических модификаций не имеет. Атомный радиус 1,75
), аллотропических модификаций не имеет. Атомный радиус 1,75 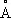 , ионные радиусы: Pb 2+1,26
, ионные радиусы: Pb 2+1,26 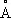 , Pb 4+0,76
, Pb 4+0,76 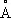 : плотность 11,34 г/см 3 (20°С); t nл 327,4 °С; t kип 1725 °С; удельная теплоёмкость при 20°С 0,128 кдж/ ( кг · К ) [0,0306 кал/г ·°С]; теплопроводность 33,5 вт/ ( м · К )[0 , 08 кал/ ( см · сек · о С )] ; температурный коэффициент линейного расширения 29,1·10 -6при комнатной температуре; твёрдость по Бринеллю 25—40 Мн/м 2 (2,5—4 кгс/мм 2 ) ; предел прочности при растяжении 12—13 Мн/м 2, при сжатии около 50 Мн/м 2; относительное удлинение при разрыве 50—70%. Наклёп не повышает механических свойств С., т. к. температура его рекристаллизации лежит ниже комнатной (около —35 °С при степени деформации 40% и выше). С. диамагнитен, его магнитная восприимчивость — 0,12·10 -6. При 7,18 К становится сверхпроводником.
: плотность 11,34 г/см 3 (20°С); t nл 327,4 °С; t kип 1725 °С; удельная теплоёмкость при 20°С 0,128 кдж/ ( кг · К ) [0,0306 кал/г ·°С]; теплопроводность 33,5 вт/ ( м · К )[0 , 08 кал/ ( см · сек · о С )] ; температурный коэффициент линейного расширения 29,1·10 -6при комнатной температуре; твёрдость по Бринеллю 25—40 Мн/м 2 (2,5—4 кгс/мм 2 ) ; предел прочности при растяжении 12—13 Мн/м 2, при сжатии около 50 Мн/м 2; относительное удлинение при разрыве 50—70%. Наклёп не повышает механических свойств С., т. к. температура его рекристаллизации лежит ниже комнатной (около —35 °С при степени деформации 40% и выше). С. диамагнитен, его магнитная восприимчивость — 0,12·10 -6. При 7,18 К становится сверхпроводником.
Конфигурация внешних электронных оболочек атома Pb 6s 2 6р 2, в соответствии с чем он проявляет степени окисления +2 и +4. С. сравнительно мало активен химически. Металлический блеск свежего разреза С. постепенно исчезает на воздухе вследствие образования тончайшей плёнки PbO, предохраняющей от дальнейшего окисления. С кислородом образует ряд окислов Pb 2O, PbO, PbO 2, Pb 3O 4и Pb 2O 3(см. Свинца окислы ) .
В отсутствие O 2вода при комнатной температуре на С. не действует, но он разлагает горячий водяной пар с образованием окиси С. и водорода. Соответствующие окислам PbO и PbO 2гидроокиси Pb (OH) 2и Pb (OH) 4имеют амфотерный характер.
Соединение С. с водородом PbH 4получается в небольших количествах при действии разбавленной соляной кислоты на Mg 2Pb. PbH 4— бесцветный газ, который очень легко разлагается на Pb и H 2. При нагревании С. соединяется с галогенами, образуя галогениды PbX 2(X — галоген). Все они малорастворимы в воде. Получены также галогениды PbX 4: тетрафторид PbF 4— бесцветные кристаллы и тетрахлорид PbCl 4— жёлтая маслянистая жидкость. Оба соединения легко разлагаются, выделяя F 2или Cl 2; гидролизуются водой. С азотом С. не реагирует . Азид свинцаPb ( N 3 ) 2 получают взаимодействием растворов азида натрия NaN 3и солей Pb (II); бесцветные игольчатые кристаллы, труднорастворимые в воде; при ударе или нагревании разлагается на Pb и N 2 со взрывом. Сера действует на С. при нагревании с образованием сульфида PbS — чёрного аморфного порошка. Сульфид может быть получен также при пропускании сероводорода в растворы солей Pb (II); в природе встречается в виде свинцового блеска — галенита.
В ряду напряжений Pb стоит выше водорода (нормальные электродные потенциалы соответственно равны — 0,126 в для Pb Û Pb 2++ 2e и + 0,65 в для Pb Û Pb 4++ 4e). Однако С. не вытесняет водород из разбавленной соляной и серной кислот, вследствие перенапряжения H 2на Pb, а также образования на поверхности металла защитных плёнок труднорастворимых хлорида PbCl 2и сульфата PbSO 4. Концентрированные H 2SO 4и HCl при нагревании действуют на Pb, причём получаются растворимые комплексные соединения состава Pb (HSO 4) 2и H 2[PbCl 4]. Азотная, уксусная, а также некоторые органические кислоты (например, лимонная) растворяют С. с образованием солей Pb (II). По растворимости в воде соли делятся на растворимые (ацетат, нитрат и хлорат свинца), малорастворимые (хлорид и фторид) и нерастворимые (сульфат, карбонат, хромат, фосфат, молибдат и сульфид). Соли Pb (IV) могут быть получены электролизом сильно подкисленных H 2SO 4растворов солей Pb (II); важнейшие из солей Pb (IV) — сульфат Pb (SO 4) 2и ацетат Pb (C 2H 3O 2) 4. Соли Pb (IV) склонны присоединять избыточные отрицательные ионы с образованием комплексных анионов, например плюмбатов (PbO 3) 2-и (PbO 4) 4-, хлороплюмбатов (PbCl 6) 2-, гидроксоплюмбатов [Pb (OH) 6] 2-и др. Концентрированные растворы едких щелочей при нагревании реагируют с Pb с выделением водорода и гидроксоплюмбитов типа X 2[Pb (OH) 4].
Читать дальшеИнтервал:
Закладка:
