БСЭ БСЭ - Большая Советская Энциклопедия (ХИ)
- Название:Большая Советская Энциклопедия (ХИ)
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
БСЭ БСЭ - Большая Советская Энциклопедия (ХИ) краткое содержание
Большая Советская Энциклопедия (ХИ) - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Среди современных кратких Х. э. и словарей представляют интерес следующие издания: по общей и неорганической химии — Albu С. D., Brezeanu М., Mică enciclopedie de chimie, Buc., 1974; «Brockhaus ABC Chemie», Bd 1—2, Lpz., 1971; Carraro F., Dicionário de quimica, Porto Alegre, 1970; «The condensed chemical dictionary», ed. A. Rose, E. Rose, 7 ed., N. Y., 1966; «New dictionary of chemistry», ed. L. Miall, 3 ed., L., 1961; DuvaI C., DuvaI R., Dolique R., Dictionnaire de la chimie et de ses applications, 2 ed., P., 1959; «The encyclopedia of chemistry», ed. C. A. Hampel, G. G. Hawley, 3 ed., N. Y., 1973; Giua М., Giua-Lollini C., Dizionario de chimica. Generale e industriale, 2 ed., v. 1—3, Torino, 1948—50; Kingzett's chemical encyclopaedia. A digest of chemistry and its industrial applications, ed. D. Hey, 9 ed., L., 1966; «Кратка химическа энциклопедия», редактор С. Гуцов и др., т. 1—2, София, 1971—72; «The Merck Index. An encyclopedia of chemicals and drugs», ed. P. Stecher, 8 ed., Rahway — N. Y., 1968; Sittig M., Inorganic chemical and metallurgical process encyclopedia, L., 1968; Van Nostrand's International encyclopedia of chemical science, N. Y. — [а. о.], 1964; «Неорганическая химия. Энциклопедия школьника», гл. ред. И. П. Алимарин, М., 1975; по фической химии — «The encyclopedia of electrochemistry», ed. C. Hampel, N. Y. — L., 1964; Clark G. L., The encyclopedia of x-rays and gamma-rays, N. Y., 1963; по химии полимеров — «Энциклопедия полимеров», гл. ред. В. А. Кабанов, t. 1—3, М., 1972—1977; «Characterization of polymers. Encyclopedia reprints», ed. N. Bikales, N. Y. — L., 1971; по аналитической химии и лабораторной технике — «Encyclopedia of industrial chemical analysis», ed. F. D. Snell, C. L. Hilton, Z. S. Ettre, v. 1—20, N. Y., 1966—74; «The encyclopedia of microscopy», ed. G. Clark, N. Y. — L., 1961; «Encyclopedia of microscopy and microtechnique», ed. P. Gray, N. Y., 1973; Parr N. L., Laboratory Handbook, L., 1963; по прикладной химии и химической технологи и — «Dictionary of chemistry and chemical technology». In six languages, ed. Z. Sobecka, Oxf. — Warsz., 1965; Stewart J., An encyclopedia of the chemical process industries, N. Y., 1956; «The encyclopedia of chemical process equipment», ed. W. J. Mead, N. Y., 1974.
Сведения по химии и химической технологии включаются также в универсальные энциклопедии и технические энциклопедии и словари, например в Большой советской энциклопедии (3 изд.) более 4000 статей, посвященных основным вопросам теоретической и прикладной химии.
Лит.: Терентьев А. П., Яновская Л. А., Химическая литература и пользование ею, 2 изд., М., 1967; Фигуровский Н. А., Очерк общей истории химии. От древнейших времён до начала XIX в., М., 1969; Джуа М., История химии, пер. с итал., 2 изд., М., 1975; Mellon M. G., Chemical publications, their nature and use, 4 ed., N. Y., 1965.
А. М. Дубинская, Э. Л. Призмент.
Химический потенциал
Хими'ческий потенциа'л(m i ), термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. В случае системы, состоящей из i компонентов, Х. п. определяется как приращение внутренней энергии U системы при добавлении к системе бесконечно малого количества молей i -того компонента, отнесённое к этому количеству вещества, при постоянных объёме V , энтропии S и количествах молей каждого из остальных компонентов n j ( j ¹ i ). В общем случае Х. п. может быть определён как приращение любого из остальных потенциалов термодинамических системы при различных постоянных параметрах: гиббсовой энергии G — при постоянных давлении р , температуре Т и n j ; гельмгольцевой энергии А — при постоянных V , Т и n j ; энтальпии Н — при постоянных S , р и n j . Таким образом:
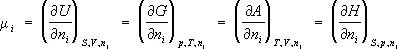 (1)
(1)
Х. и. зависит как от концентрации данного компонента, так и от вида и концентрации др. компонентов системы (фазы). Только в простейшем случае — смеси идеальных газов — m i зависит лишь от концентрации рассматриваемого компонента и от температуры:
m i = m i 0+ RT In p i ,
где p i — парциальное давление компонента i в смеси, R — газовая постоянная , m i 0— значение m i при p i = 1 атм . Для смеси неидеальных газов в равенстве (2) должна стоять фугитивность этого компонента. Х. п. характеризует способность рассматриваемого компонента к выходу из данной фазы (путём испарения, растворения, кристаллизации, химического взаимодействия и т.д.). В многофазных (гетерогенных) системах переход данного компонента может происходить самопроизвольно только из фазы, в которой его Х. п. больше, в фазу, для которой его Х. п. меньше. Такой переход сопровождается уменьшением Х. п. этого компонента в 1-й фазе и увеличением во 2-й. В результате разность между Х. п. данного компонента в этих двух фазах уменьшается и при достижении равновесия Х. п. компонента становится одинаковым в обеих фазах. В любой равновесной гетерогенной системе Х. п. каждого компонента одинаков во всех фазах.
Если в различных фазах или в разных местах одной фазы Х. п. какого-либо компонента неодинаков, то в системе самопроизвольно (без затраты энергии извне) происходит перераспределение частиц, сопровождающееся выравниванием Х. п.
Из условий термодинамического равновесия систем, в которых возможны химические реакции, фазовые переходы и др. процессы перераспределения частиц, и уравнения, учитывающего баланс частиц, вытекают важнейшие термодинамические соотношения: действующих масс закон , фаз правило Дж. У. Гиббса , основные законы разбавленных растворов (см. Вант-Гоффа закон , Рауля законы , Генри закон и др.) и т.д.
Х. п. в качестве нормировочной постоянной входит в распределение Больцмана, а также в распределения по энергиям Бозе — Эйнштейна и Ферми — Дирака для частиц идеального газа (см. Статистическая физика ). Х. п. вырожденного газа электронов ( ферми-газа ) тождественно совпадает с граничной ферми энергией .
Х. п. был введён Гиббсом, численно выражается в единицах энергии на единицу количества вещества ( дж/моль ) или на единицу массы ( дж/кг ).
Лит. см. при статьях Термодинамика , Статистическая физика .
И. А. Кузнецов.
Химический ракетный двигатель
Хими'ческий раке'тный дви'гатель, ракетный двигатель , у которого для создания тяги используется химическая энергия топлива. Основной вид ракетного двигателя. В Х. р. д. применяется жидкое, твёрдое и гибридное ракетное топливо ; соответственно различают жидкостные ракетные двигатели , твердотопливные ракетные двигатели и ракетные двигатели гибридного топлива. Для вспомогательных систем космических летательных аппаратов разработаны также Х. р. д., использующие пары жидкого ракетного топлива, газообразные продукты электролиза воды или газообразное монотопливо. Двигательные установки с Х. р. д. имеют тягу от долей н до десятков Мн и удельный импульс до 5 кн × сек/кг (экспериментальный Х. р. д. на топливе фтор — литий — водород). При создании топлив на основе свободных атомов и радикалов либо возбуждённых атомов и молекул ожидается увеличение удельного импульса Х. р. д. до 10—20 кн × сек/кг .
Читать дальшеИнтервал:
Закладка:
