Максим Франк-Каменецкий - Самая главная молекула. От структуры ДНК к биомедицине XXI века
- Название:Самая главная молекула. От структуры ДНК к биомедицине XXI века
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2017
- Город:Москва
- ISBN:978-5-9614-4522-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Максим Франк-Каменецкий - Самая главная молекула. От структуры ДНК к биомедицине XXI века краткое содержание
Самая главная молекула. От структуры ДНК к биомедицине XXI века - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Надо только, чтобы вектор и ДНК, несущая здоровый ген, проникли в клеточное ядро, дальше все происходит само собой. Транскрибируются две молекулы крРНК и мРНК кас-белка, которая транслируется в цитоплазме, и кас-белок проникает назад в ядро. Система крРНК и кас-белка вырезает мутантный ген из генома, а репарирующая система в процессе залечивания двунитевого разрыва использует для гомологичной рекомбинации введенную ДНК, несущую здоровый ген β-цепи гемоглобина. В результате происходит то, что мы хотели: мутантный ген заменен на здоровый (рис. 46). Осталось только вернуть отредактированные клетки назад в организм пациента, чтобы они стали производить красные кровяные клетки, содержащие нормальный, здоровый гемоглобин.
Технология редактирования генома с помощью КРИСПР-кас, как обычно обозначается описанная методика, обладает громадными преимуществами по сравнению с генной инженерией, о которой речь шла выше в этой главе, и по сравнению с другими методами редактирования генома. Главное, что эта технология позволяет резать и сшивать ДНК внутри живой клетки, причем делать это довольно просто и дешево. Конечно, имеются свои проблемы, главная из которых – это доставка в клеточное ядро крРНК и кас-белка или векторов, которые их экспрессируют. Имеется несколько способов такой доставки, но все они далеко не идеальны. Конечно, были бы гораздо лучше, если бы аналог кас-белка существовал в эукариотической клетке и требовалось бы только доставить крРНК, подобно тому, как в случае системы РНК-интерференции нужно доставить только киРНК (см. главу 12). Но пока что такие поиски не привели к успеху, и надо довольствоваться тем, что имеется, а это уже очень много.
В сотнях лабораторий во всем мире идет неустанная, подчас лихорадочная работа по использованию новой технологии редактирования генома в самых разных областях. Конечно, хотя эта методика открывает захватывающие воображение перспективы генной терапии типа нашего примера с СКА, внедрение новой технологии в медицинскую практику – это долгий путь. Хотя, как будет рассказано в главе 12, отдельные клинические испытания на безнадежно больных пациентах, которым не помогли все остальные методы лечения, уже проводятся. Но то, что продвигается с молниеносной скоростью, это применения нового метода там, где не требуется редактировать геном человека. Уже созданы новые сорта овощей и фруктов, устойчивые к гербицидам, не портящиеся при транспортировке и т. д. Сообщается, что средняя частота поступления в патентную администрацию США заявок на патенты в области КРИСПР-кас соответствует одной заявке каждый божий день.
Пожалуй, наиболее яркий пример того, в каком направлении идут исследования, – это работа, опубликованная в конце 2015 года группой исследователей во главе с Тони Ноланом из Имперского колледжа в Лондоне. Речь идет, ни много ни мало, о разработке метода уничтожения целых видов животных, которые приносят вред человеку, например комаров, переносящих малярию. Как же такое можно сделать? Хорошо известно, что малярийный плазмодий переносится только самками определенного вида комаров, поскольку только самки пьют кровь, чтобы производить потомство. Самцы совершенно безвредны. Уже давно возникла идея генетически модифицировать самцов, чтобы они несли ген бесплодия самок. Как и ген СКА, это рецессивный аутосомный ген (т. е. он находится в неполовой хромосоме), и он должен быть в гомозиготном состоянии, чтобы приводить к бесплодию (т. е. он должен присутствовать в обеих аллелях комариных клеток). Если запустить в популяцию самцов, несущих ген бесплодия во всех своих гаметах (т. е. сперматозоидах), это не приведет к бесплодию самок первого поколения. Лишь при встрече самок первого поколения с несущими ген бесплодия самцами будут рождаться бесплодные самки (и то только в половине случаев). Но при оплодотворении самок первого поколения нормальными самцами бесплодных самок не будет появляться. Так что, чтобы уменьшить популяцию комаров, нужно нарастить и выпустить в экосистему чертову уйму самцов, несущих ген бесплодия. Не очень-то эффективно получается.
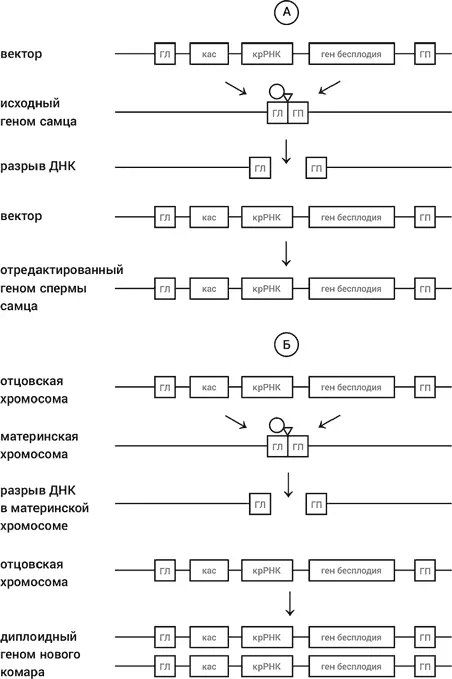
Рис. 47.Использование технологии КРИСПР-кас для создания бесплодных комаров. А. Создается вектор, содержащий конструкцию, состоящую из гена бесплодия, гена крРНК и гена кас. На левом и правом концах конструкция имеет два участками, ГЛ и ГП, которые в геноме комара находятся слева и справа от участка, узнаваемого молекулой крРНК. Этот вектор вводится в комариного самца, и в результате гаметы самца несут всю конструкцию. Б. Когда такой ГМО-комар оплодотворяет нормальную самку, зигота сначала оказывается гетерозиготной относительно всей конструкции. Однако вскоре после возникновения зиготы в ней происходит экспрессия генов крРНК и кас в отцовской хромосоме, в результате чего нормальная материнская хромосома оказывается отредактированной: в нее переносится из отцовской хромосомы вся конструкция. Возникает гомозиготный комар. Если это самец, то у него все сперматозоиды несут конструкцию, если это самка, то она к тому же бесплодна
Ну а что дает технология редактирования генома? Нолан с соавторами ввели в самцов вектор, содержащий ген крРНК, ген, кодирующий кас-белок, и ген бесплодия. Дизайн крРНК был таким, что двунитевой, разрыв должен был происходить в месте на хромосоме, где должен быть размещен ген бесплодия. На левом и правом концах конструкция из трех генов содержала две последовательности, гомологичные последовательностям, расположенным слева и справа от места разрыва (рис. 47). Экспрессия вектора в клетках самца приводит, очевидно, к тому, что вся конструкция (назовем ее КРИСПР-конструкцией), расположенная между двумя концевыми последовательностями, встраивается в геном комара. Что происходит, когда такой генно-модифицированный самец (ГМО-комар), несущий КРИСПР-конструкцию в своих гаметах, выпускается в популяцию нормальных малярийных комаров? Он оплодотворяет самку, не несущую гена бесплодия, и все потомки первого поколения, и самцы, и самки, должны, согласно законам Менделя, быть гетерозиготами. Но уже в зиготе потомков первого поколения происходит экпрессия КРИСПР-конструкции, в результате чего в доставшуюся от самки нормальную хромосому вставляется вся КРИСПР-конструкция, включая ген бесплодия. Зачатые как гетерозиготы, комары уже в первом поколении превращаются в гомозиготы в отношении гена бесплодия!
Такие гомозиготные самки бесплодны, а гомозиготные самцы чувствуют себя совершенно нормально и готовы к оплодотворению. Причем все гаметы самцов будут нести КРИСПР-конструкцию. Так, через несколько поколений ген бесплодия завладевает популяцией, в ней не остается плодовитых самок. Популяция малярийных комаров вымирает. Такое развитие событий немыслимо с точки зрения канонических законов Менделя и с точки зрения популяционной генетики. Начав с ниспровержения запрета на наследование благоприобретенных признаков у бактерий, система КРИСПР-кас при перенесении на животных ниспровергла законы Менделя и законы популяционной генетики. Слыханное ли дело: зачатая как гетерозигота вдруг превращается в гомозиготу, а ген бесплодия завладевает всей популяцией! И это все не фантазии и не прожекты – такие ГМО-комары уже существуют в лаборатории Нолана. Успешное создание ГМО-комаров ясно иллюстрирует, насколько радикальным шагом является технология редактирования генома КРИСПР-кас по сравнению с генной инженерией. Главное различие в том, что редактирование генома происходит в живой клетке и поэтому удается ввести в действие автономную программу геномной перестройки, которая сама включается вновь и вновь в каждом поколении, без вмешательства экспериментатора, и представляет собой вопиющее нарушение законов классической генетики.
Читать дальшеИнтервал:
Закладка:










