Амос Фрайс - Химическая война
- Название:Химическая война
- Автор:
- Жанр:
- Издательство:Государственное Военное Издательство
- Год:1924
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Амос Фрайс - Химическая война краткое содержание
Химическая война - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Склад соли и здание для обработки ее были расположены на более низком уровне, чем здания батарей, что позволяло провести рельсовый путь к верхней части цистерн, в которых хранилась соль. Все цистерны были сделаны из цемента. Имелось 7 цистерн длиной в 84 фута, шириной в 28 футов и глубиной в 20 футов, при чем каждая вмещала по 4.000 тонн соли. Ежедневно предполагалось расходовать 200 тонн соли, если завод будет в полном ходу.
Ко дну каждой цистерны были проведены трубы, по которым подавалась вода для растворения, а в верхней части ее, около стены здания, находился жолоб для стока рассола и доска для снимания пены. Таким образом вода, прошедшая через соль, стекала в жолоб, и оттуда по трубам рассол протекал в один из двух приемников. Вся система была устроена так, что, если раствор в одной цистерне оказывался недостаточно насьпценным, он мог быть пропущен через другую цистерну, содержащую большой избыток нерастворенной соли. Насыщенный раствор перекачивали из приемника в один из 24 чанов для обработки, вмещавший каждый по 72.000 галлонов.
Восьмая цистерна служила для хранения натровой золы, употреблявшейся для очищения насыщенного раствора соли. Из нее едкий натр подавался в баки для растворения, построенные на одном уровне с цистернами поваренной соли. Отсюда раствор едкой щелочи перекачивался в одну из 24 цистерн, служивших для очищения рассола. После обработки и отстаивания чистый насыщенный раствор соли перекачивался в один из 4 баков для нейтрализации. Эти баки были расположены около платформы, куда подавались вагоны, чтобы легче было пропускать хлоро-водородный газ, который сначала покупали, но потом стали приготовлять на заводе из хлора и водорода. Нейтрализованный раствор стекал самотеком в здание батарей для электролиза.
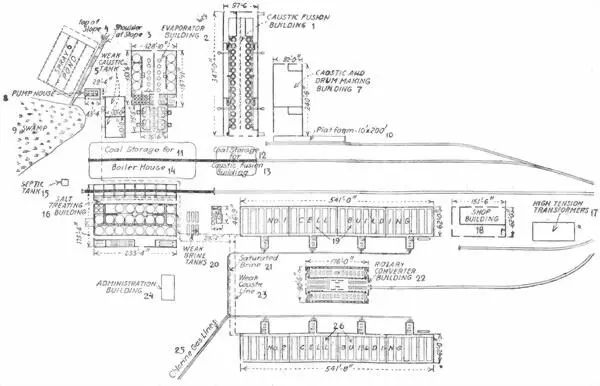
Рис. 20.
План завода для производства хлора и едкого натра в Эджвудском арсенале.
1. Корпус для плавки едкого натра.
2. Корпус выпарения.
3. Наклонная плоскость для погрузки.
4. Вершина наклон. плоскости.
5. Баки со слабым раствором едкого шатра.
6. Под'ездные пути.
7. Корпус для едкого шатра и барабанов.
8. Насосная станция.
9. Болото.
10. Платформа.
11 — 14. Склад угля для паровых котлов.
15. Бак для отбросов.
16. Корпус обработки соляными растворами.
17. Трансформаторы высокого направления.
18. Мастерская.
19. Корпус № 1 для батарей.
20. Бак для слабых растворов.
21. Насыщенный раствор.
22. Корпус вращающихся конверторов.
23. Трубопровод слабого раствора едкого шатра.
24. Здание управления заводом.
25. Труба газообразного хлора.
26. Корпус № 2 для батарей.
Было построено два здания батарей по 541 фут. длиною и 28 шириною, из которых каждое было, разделено на 4 отделения, вмещающие по 6 батарей, состоящих из 74 элементов. Каждое отделение являлось вполне самостоятельной единицей, снабженной отдельным газовым насосом, сушильным и охлаждающим аппаратом с пропускной способностью на 12,5 тонн газообразного хлора в сутки.

Рис. 21.
Внутренний вид здания с батареями.
Каждая электролитическая батарея Нельсона состоит из цельной стальной ванны 13 × 32 × 80 дюймов, снабженной стальной перегородкой с отверстиями которая поддерживается на железных углах. Сосуд покрыт стеклянным колпаком и снабжен четырнадцатью атчесоновскими графитными электродами в 2,5 дюйма в диаметре и 12 дюймами длины, 14 кусками графита 4 × 4 × 17 дюймов и другими приспособлениями. (Устройство батареи подробно описано в "Химическом и Металлургическом Инженерном Журнале" от 1-ro августа 1919 г.). Каждая батарея питается током в 840 ампер при 3,8 вольт и дает 60 фунтов газообразного хлора и 65 фунтов едкого натра, потребляя не свыше 120 фунтов соли в сутки и выделяя почти совершенно чистый газ 95 %.
Из цистерны, питающей батарею и расположенной в здании обработки, раствор соли переходит самотеком по системе труб, обходящих вдоль корпуса батарей, и подается в каждую ванну посредством особого автоматического прибора, который поддерживает постоянный уровень жидкости в отделении катодов'.
При электролизе раствор просачивается через асбестовую перегородку из катодного отделения батареи в отделение анодов и вытекает у конца ванны, содержа от 8 до 12 % едкого натра, смешанного с 14–16 % соли, в открытый сток и трубу, через которую самотеком переходит в баки слабого раствора едкого натра.
Все трубы, по которым газ идет от батарей до сушильных аппаратов, сделаны из химически стойкого материала. Давление в отводных трубах для хлора поддерживалось возможно ближе к атмосферному, для того, чтобы газ был свободен от воздуха. Качество газа, таким образом, было доведено до 98,5 — 99 % чистоты.
Применявшиеся охладители имели большую силу; при их помощи газ охлаждался на 1 градус ниже температуры замерзания оды, вследствие чего охлаждающих смесей не требовалось. Сушильный аппарат состоял из каменной турмы специального чертежа, содержавшей значительное количество пластин для увеличения поверхности, Давление при прохождении через сушилку и охладитель не повышалось. Аппарат, накачивавший газ, состоял из двух водяных турбинных насосов, в которых серная кислота применялась как компрессорная среда. Кислота охлаждалась пропусканием через двойной охлаждающий змеевик, подобный имеющимся в холодильных машинах. Газ под давлением приблизительно в 5 фунтов поступал в большие баки, расположенные около помещения насосов, а из них шел по стальным трубам на химический завод".
Газ получался настолько чистым, что не считалось нужным ожижать его для приготовления фосгена.
Хлор при обыкновенном атмосферном давлении и температуре является газом зеленовато-желтого цвета (оправдывая свое название), который оказывает сильно раздражающее действие на оболочки носа и гортани. Как было упомянуто, хлор сгущается в жидкость при давлении 16,5 атмосфер при 18 °C. Если газ сначала охладить до 0°, то давление, необходимое для его сгущения, понижается до 3,7 атмосферы. Эта желтая жидкость кипит при — 36,6 °C под атмосферным давлением. При очень сильном охлаждении хлор образует бледно-желтое твердое вещество (при — 102 °C). Хлор в 2,5 раза тяжелее воздуха; 1 литр его весит 3,22 грамма. 215 об'емов растворяются в 100 об'емах воды при 20°. Он очень слабо растворим в горячей воде или насыщенном растворе соли.
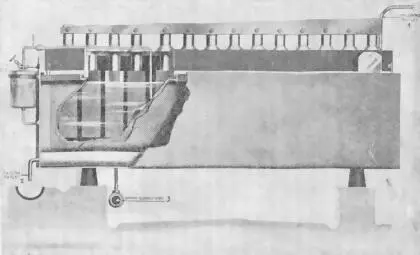
Рис. 22.
Читать дальшеИнтервал:
Закладка:









