Фридрих Энгельс - Анти-Дюринг. Диалектика природы
- Название:Анти-Дюринг. Диалектика природы
- Автор:
- Жанр:
- Издательство:Литагент «Стрельбицький»f65c9039-6c80-11e2-b4f5-002590591dd6
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Фридрих Энгельс - Анти-Дюринг. Диалектика природы краткое содержание
Произведение Фридриха Энгельса «Переворот в науке, произведённый господином Евгением Дюрингом» стало известным во всем мире под названием «Анти-Дюринг». Книга включает в себя три части: философия, политическая экономия и социализм.
Труд Энгельса стал основополагающим произведением диалектического материализма, одним из источников революционной теории марксизма, в значительной мере повлиявшим на ход истории 20 века.
Анти-Дюринг. Диалектика природы - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Но вернемся к вышеприведенному примеру III. Там один и тот же ток вызывал электролитическое разложение соляной кислоты в двух U-образных трубках, но в одной из них положительным электродом был цинк, а в другой – медь. Согласно основному электролитическому закону Фарадея, один и тот же гальванический ток разлагает в каждой электролитической ванне эквивалентные количества электролитов, и количества выделенных на обоих электродах веществ относятся друг к другу тоже как их эквиваленты (кн. I, стр. 470). Между тем оказалось, что в вышеприведенном случае в первой трубке растворилось 32,53 цинка, а во второй 2 x31,7 меди.
«Но», – продолжает Видеман, – «это вовсе не есть доказательство эквивалентности этих количеств. Они наблюдаются только в случае очень слабых токов, при образовании… с одной стороны, хлористого цинка, а с другой… хлористой меди. В случае более сильных токов количество растворенной меди при том же самом количестве растворенного цинка опустилось бы… до 31,7, а количество образовавшегося при этом хлористого соединения соответственно увеличилось бы».
Цинк, как известно, образует только одно соединение с хлором – хлористый цинк ZnCl 2, медь же – два: хлорную медь CuCl 2и хлористую медь Cu 2Cl 2. Явление происходит, следовательно, таким образом, что слабый ток отрывает от электрода на каждые два атома хлора два атома меди, которые остаются связанными между собой при помощи одной из двух своих единиц сродства, между тем как две их свободные единицы сродства соединяются с двумя атомами хлора:
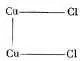
Если же ток становится сильнее, то он совершенно отрывает атомы меди друг от друга, и каждый из них в отдельности соединяется с двумя атомами хлора:
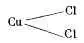
При токах средней силы оба эти вида соединений образуются рядом друг с другом. Таким образом, образование того или другого из этих соединений зависит исключительно лишь от силы тока, и поэтому весь процесс носит по существу электро-химический характер, если это слово имеет вообще какой-нибудь смысл. Несмотря на это, Видеман категорически объявляет его вторичным, т. е. не электро-химическим, а чисто химическим процессом.
Вышеприведенный опыт принадлежит Рено (1867 г.) и относится к целому ряду аналогичных опытов, в которых один и тот же ток проводился в U-образной трубке через раствор поваренной соли (положительный электрод – цинк), а в другой ванне через различные электролиты с различными металлами в качестве положительных электродов. При этом растворенные на один эквивалент цинка количества других металлов показали большие отклонения, и Видеман приводит результаты всего ряда опытов, которые, однако, в большинстве случаев химически вполне понятны и никак не могут быть иными. Так, например, на 1 эквивалент цинка в соляной кислоте растворялось только 2 / 3 эквивалента золота. Это может казаться странным лишь в том случае, если, подобно Видеману, придерживаться старых эквивалентных весов и изображать хлористый цинк через ZnCl, где как хлор, так и цинк фигурируют в хлористом соединении каждый только с одной единицей сродства. В действительности же здесь на один атом цинка приходится два атома хлора (ZnCl 2), и, зная эту формулу, мы сразу же видим, что в вышеприведенном определении эквивалентов за единицу надо принимать атом хлора, а не атом цинка. Формулу же для хлорного золота надо писать AuCl 3; в этом случае ясно, что 3ZnCl 2содержат ровно столько же хлора, сколько 2AuCl 3, и что поэтому все процессы в цепи или электролитической ванне (первичные, вторичные и третичные) вынуждены будут на одну превращенную в хлористый цинк весовую часть [442]цинка превращать в хлорное золото не больше и не меньше чем 2/3 весовой части золота. Это имеет абсолютное значение, если только не предположить, что гальваническим путем можно получить также и соединение AuCl: в этом последнем случае на 1 эквивалент цинка должны были бы быть растворены даже 2 эквивалента золота, и, следовательно, могли бы иметь место, в зависимости от силы тока, такие же вариации, какие были указаны выше на примере меди и хлора. Значение опытов Рено заключается в том, что они показывают, как закон Фарадея подтверждается фактами, как будто бы противоречащими ему. Но совершенно непонятно, какое значение они должны иметь для объяснения вторичных процессов при электролизе.
Третий пример Видемана привел нас уже опять от электролитической ванны к цепи. И действительно, наибольший интерес представляет цепь, если исследовать электролитические процессы с точки зрения происходящих при этом превращений энергии. Так, мы нередко наталкиваемся на такие цепи, в которых химико-электрические процессы как будто находятся в прямом противоречии с законом сохранения энергии и совершаются как будто вопреки законам химического сродства.
Согласно измерениям Поггендорфа, [443]цепь: цинк, концентрированный раствор поваренной соли, платина – дает ток силой в 134,6. [444]Таким образом, мы имеем здесь довольно солидное количество электричества, на 1/ 3больше, чем в элементе Даниеля. Где же источник появляющейся здесь в форме электричества энергии? «Первичным» процессом является здесь вытеснение цинком натрия из его соединения с хлором. Но в обычной химии не цинк вытесняет натрий из хлористых и других соединений, а, наоборот, натрий вытесняет цинк. «Первичный» процесс не только не в состоянии дать току вышеуказанного количества энергии, но, наоборот, сам нуждается для своего осуществления в притоке энергии извне. Таким образом, с одним лишь «первичным» процессом мы опять-таки не двигаемся с места. Поэтому рассмотрим, как процесс происходит в действительности. Мы находим, что происходящее здесь превращение выражается не через
Zn + 2NaCl = ZnCb + 2Na,
а через
Zn + 2NaCl + 2H2O = ZnCl2 + 2NaOH + H2. Иными словами: натрий не выделяется в свободном виде на отрицательном электроде, а превращается в гидрат окиси, как выше в примере I (стр. 459—460).
Для вычисления происходящих при этом превращений энергии мы имеем по меньшей мере опорные пункты в определениях Юлиуса Томсена. Согласно им, мы имеем следующее количество освободившейся энергии при соединениях:
(Zn, Cl 2) = 97 210 (ZnCl2, aqua) = 15 630 итого для растворенного ZnCl 2 : 112840 единиц теплоты
2 (N, O, H, aqua) = 223 620 " "
336 460 " "
Отсюда надо вычесть количество энергии, потраченное при разделениях:
329 740 " "
Избыток освободившейся энергии = 6720 единицам теплоты.
Этого количества, конечно, мало для полученной Поггендорфом силы тока, но его достаточно, чтобы объяснить, с одной стороны, отделение натрия от хлора, а с другой – образование тока вообще.
Читать дальшеИнтервал:
Закладка:










