Adela Paez - Революция в воздухе. Лавуазье. Современная химия.
- Название:Революция в воздухе. Лавуазье. Современная химия.
- Автор:
- Жанр:
- Издательство:Де Агостини
- Год:2015
- Город:М.:
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Adela Paez - Революция в воздухе. Лавуазье. Современная химия. краткое содержание
Революция в воздухе. Лавуазье. Современная химия. - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
На самом деле алмазы исчезали из-за процесса горения, то есть из-за взаимодействия угля с кислородом, где «фиксируемый воздух» Блэка — это СO 2:
С (твердое вещество) + O 2(газ) → СO 2(газ).
Рубины не реагируют с кислородом из воздуха, поскольку алюминий окислен и уже вступил в реакцию с кислородом.
Установив однажды эффективность «солнечной печи», Лавуазье продолжал использовать ее для опытов с нагреванием. Чтобы понять процесс горения, он сначала изучил изменения, которые претерпевали другие, не металлические вещества — фосфор и сера. Уже давно было известно, что белый фосфор самопроизвольно возгорается и при этом легко наблюдаемом процессе выделяется большое количество тепла.
Когда Лавуазье принялся за его изучение, он получил дополнительную информацию: Антуан подтвердил то, на что уже указал Гейле: вес фосфора сильно увеличивается в процессе горения. В отличие от продукта, образовывавшегося во время горения алмазов, продукт, получавшийся во время горения фосфора, был плотным, и это позволяло его точно взвесить. В конце 1772 года Лавуазье послал в Академию письмо, в котором объяснял, что фосфор поглощает воздух в большом количестве и вместо того, чтобы терять вес (чего можно было ожидать из- за потери флогистона), наоборот, приобретает вес, равный поглощенному воздуху. Образовывающееся новое вещество было «кислотным духом фосфора», поскольку при смешивании его с водой получалось то, что мы называем сегодня фосфорной кислотой.
P 4+ 5O 2→ P 4O 10,
P 4O 10+ 6H 2O→ 4H 3PO 4.
Проведя сходный опыт с серой, Лавуазье заметил подобный эффект: продукт сгорания весил больше, чем исходная сера, а при смешивании с водой образовывал то, что известно сегодня под названием серной кислоты. Он заметил также, что из одного фунта серы получалось больше одного фунта кислоты.
S + 3/2 O 2→ SO 3;
SO 3+ H 2O → H 2SO 4.
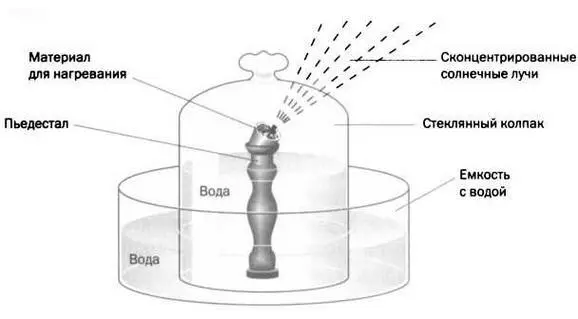
РИС. 1
Следующим шагом стало изучение превращения «извести» металла (свинцового глета или оксида свинца) при нагревании с помощью линзы Чирнгаузена вместе с углем, который, как мы уже видели, считался тогда источником флогистона.
Лавуазье собрал «эластичный флюид» (хотя Ван Гельмонт предложил слово «газ» веком раньше, оно еще не использовалось), который собирался на воде, предварительно покрытой слоем масла, мешавшим воде поглощать газ. Чтобы измерить его, он использовал пневматическую ванну, разработанную Гейлсом.
Мы знаем сегодня, что существование элемента или соединения в твердом, жидком или газообразном состоянии зависит от его давления и температуры. Почти невозможно представить себе времена, когда газ не считался веществом.
И все же это логично: трудно изучать вещества без определенной формы и объема, невидимые, часто без запаха, которые, соответственно, с трудом можно собрать. Поэтому одним из самых важных открытий в химии до Лавуазье стало открытие существования разных видов «воздуха»» и разработка приборов для их сбора. Фламандец Ян Баптист Ван Гельмонт считается отцом «пневматической науки»», поскольку еще в XVII веке он изучал все возможные типы воздуха, хотя так и не сумел определить его состав. Ван Гельмонт выделил воздух, содержавшийся в термальных водах, который является тем же самым веществом, что образуется при горении угля либо в погребах при брожении вина (СO 2); с другой стороны, был еще воздух, который улетучивался при горении серы (SO 2), и горючий воздух, выделяющийся при гниении органики (Н 2, СН 4, H 2S). Ван Гельмонту мы обязаны и словом «газ»». Большинство историков науки утверждают, что корень данного слова происходит от греческого «хаос»», хотя Лавуазье связывал его с другим словом, означающим «призрак»». Долгое время считалось, что «обычный воздух»», то есть окружающая нас атмосфера, является просто средой, в которой происходят химические реакции, и сам по себе он никакой роли в этих реакциях не играет. В начале XVIII века опыты англичанина Стивена Гейлса и шотландца Джозефа Блэка сделали очевидным тот факт, что во время таких реакций, как горение, атмосфера может быть веществом, активно участвующим в реакции.
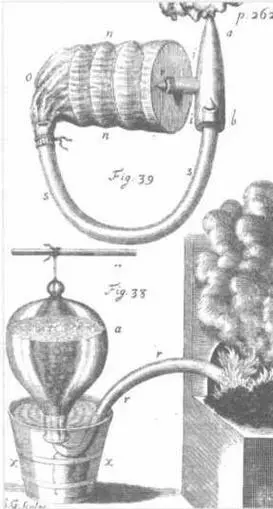
Для выделения разных типов «воздуха» необходимо, чтобы они не улетучивались в атмосферу. Поэтому Гейле придумал установку, изображенную на этой гравюре, представленной в его труде Vegetable Staticks (1727). В улучшенном виде данная установка сыграла решающую роль в определении различных газов.
Как видно на рисунке 1, речь шла о стеклянном колпаке, частично заполненном водой, в центре которого находилась пневматическая ванна с емкостью, куда помещали материал для нагревания. Сфокусированные солнечные лучи достигали емкости через поверхность колпака, который, в свою очередь, был погружен в другую емкость, также наполненную водой.
Лавуазье установил, что по мере того как уменьшалось количество «извести» и образовывался чистый металл, выделялся некий газ и уменьшался уровень воды внутри колпака. Объем произведенного газа был в 750 раз больше объема использованной окиси свинца.
Чтобы понять такое огромное увеличение объема, надо принять во внимание, что окись свинца — это твердое вещество, тогда как выделяемый «воздух» является газом, а твердые и жидкие вещества занимают гораздо меньший объем, нежели газообразные. Например, один моль любого газа в нормальных условиях (Р = 1 атм, Т = °0 С) занимает 22, 4 литра. А 1 литр воды (Н 2O), плотность которой составляет 1 грамм на миллилитр, весит 1 килограмм и содержит 55, 55 молей.
Газ: 1 моль → 22, 4 литра.
Вода (жидкая): 1 литр → 55, 55 молей.
Плотность других твердых и жидких веществ обычно больше: например, плотность меди — порядка 7 граммов на миллилитр, а ртути — больше 13.
Подтвердив увеличение объема, Лавуазье повторно провел опыт с фосфором, но на этот раз использовал закрытую емкость, чтобы определить, меняется ли объем воздуха вокруг. Он убедился, что воздух теряет между пятой и шестой частью от изначального количества. Лавуазье провел множество опытов, чтобы определить увеличение веса, и в итоге убедился, что 154 грана фосфора поглотили во время горения 80 гранов воздуха или другого «эластичного флюида», содержащегося во вдыхаемом воздухе. Гран, так же как и фунт, являлся единицей веса, используемой в то время: 1 парижский фунт =16 унций; 1 парижская унция = 8 тросов; 1 трос = 72 грана; 1 парижский фунт соответствовал 480 граммам.
Кроме того, Лавуазье заметил, что в закрытой емкости может окисляться только определенное количество фосфора. Предвосхищая важность этих опытов, но не решаясь обнародовать их объяснение, он отправил 1 ноября 1772 года в Академию наук запечатанное письмо, в котором детально изложил свои мысли:
Читать дальшеИнтервал:
Закладка:










