Евгений Айсберг - Транзистор?.. Это очень просто!
- Название:Транзистор?.. Это очень просто!
- Автор:
- Жанр:
- Издательство:Энергия
- Год:1977
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Евгений Айсберг - Транзистор?.. Это очень просто! краткое содержание
Книга содержит четырнадцать занимательных бесед, написанных в форме разговора между двумя действующими лицами.
Книга рассчитана на широкий круг читателей.
Транзистор?.. Это очень просто! - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Л. — Ничего! Пустота. Но, разумеется, существуют электрические, магнитные, гравитационные и другие силы взаимного притяжения, поддерживающие всю эту систему в состоянии равновесия. Заряды с противоположными знаками взаимно притягиваются, поэтому электроны не уходят от своего ядра, несмотря на центробежные силы, стремящиеся их оторвать от ядра.
Н. — Ты меня пугаешь. Если это так, то атом состоит скорее из пустоты, чем из материи.
Л. — Совершенно верно, мой друг! И если бы удалось спрессовать все ядра и все электроны, составляющие, к примеру, твое тело, так, чтобы между ними не осталось пустоты, то получилось бы зернышко, едва различимое под микроскопом, но весящее, как и ты, 70 кг.
Н. — У меня мурашки бегают по коже каждый раз, когда ты напоминаешь мне, что я также состою из атомов. Но теперь, когда ты открыл мне, что во мне царит пустота, я испытываю жуткое головокружение.

Л. — Поэтому мы поступим благоразумно, если в дальнейшем будем говорить о других атомах, а не об атомах твоего тела. Чтобы более наглядно представить себе строение атома, условимся обозначать каждую оболочку в виде окружности.
Как ты, очевидно, знаешь, наиболее простое строение имеет атом водорода. Он состоит из одного протона и одного электрона, находящегося на оболочке К . В атоме гелия вокруг двух протонов ядра на этой же оболочке К вращаются два электрона (рис. 3).
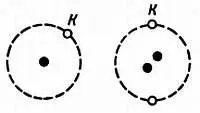
Рис. 3. Вот два самых простых атома: атом водорода (слева) и атом гелия (справа).
Н. — А какой элемент имеет три электрона на оболочке К ?
Л. — Никакой, так как эта оболочка не может иметь больше двух электронов; Точно так же оболочка L не может иметь больше 8 электронов. На оболочке М может находиться не более 18 электронов, на оболочке N — не более 32, на оболочке О — не более 50, на оболочке Р — не более 72 и на оболочке Q — не более 98 электронов.

Н. — Очень любопытна эта последовательность чисел, которые ты называешь с такой легкостью.
Л. — Тут нет моей заслуги, так как эти числа определяются по очень простому закону:
Для оболочки К : 1 2х 2 = 2.
Для оболочки L : 2 2х 2 = 8.
Для оболочки М : З 2х 2 = 18.
Для оболочки N : 4 2х 2 = 32.
Для оболочки О : 5 2х 2 = 50.
Для оболочки Р : 6 2х 2 = 72.
Для оболочки Q : 7 2х 2 = 98.
Н. — В общей сложности 280. Значит, имеются атомы, содержащие такое количество электронов.
Л. — Нет, потому что если оболочки K, L, М и N , действительно, могут иметь указанное мною количество электронов, то на оболочке О на практике их не бывает больше 18, на оболочке Р — больше 32 и на оболочке Q — больше 10 (рис. 4).
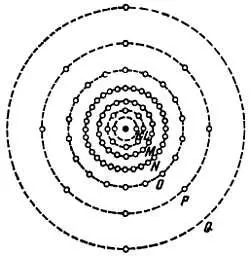
Рис. 4. Схематическое изображение атома радия, показывающее распределение электронов по различным оболочкам. В действительности орбиты располагаются в различных плоскостях.
Н. — Это очень интересно, но мне кажется, что мы рискуем заблудиться в лабиринтах атомной и ядерной физики.
Л. — Напротив, мы сейчас примем решение, которое в значительной мере облегчит нам изучение всех этих вопросов. Если ты согласен, мы будем учитывать только электроны, находящиеся на внешней оболочке атома.
Н. — Хорош же ты! Открыв мне существование многочисленных оболочек, из-за чего атом напомнил мне луковицу, ты сразу же запрещаешь мне очистить эту луковицу. Уж не хочешь ли ты уберечь меня от слез?..

Л. — Решение, которое мы должны принять, вполне законно. Что нас интересует в конечном счете? — Электрическое состояние атомов. Однако обычно атом содержит электронов столько же, сколько и протонов, в результате чего отрицательные заряды первых уравновешиваются положительными зарядами вторых. Такой атом электрически нейтрален . Но может случиться, что внешние силы вырвут у атома один или несколько электронов. В этом случае равновесие нарушается: общая сумма отрицательных зарядов электронов оказывается меньше положительного заряда ядра. Такой атом становится положительным ионом.
Н. — А если, наоборот, по той или иной причине атом получит избыточные электроны, то он станет отрицательным. Я подозреваю, что в этом случае его можно назвать отрицательным ионом.
Л. — Превосходно! Однако такие потери или приобретения электронов (именуемые ионизацией ) могут иметь место главным образом на внешней оболочке, т. е. там, где меньше проявляется сила притяжения ядра.
Н. — Да, я понимаю, что в этих условиях нас могут интересовать только электроны, находящиеся на внешней оболочке.

Л. — Для этого есть еще одна причина. Именно эта оболочка определяет химические свойства элементов. Атом действительно удовлетворен своим положением только тогда, когда имеет на своей внешней орбите 8 электронов. В этих условиях атом стабилен и не помышляет ни о приобретении, ни о потере электронов. Так, например, неон, имеющий на своей внешней оболочке L 8 электронов, весьма счастлив и не стремится вступить в связь с каким бы то ни было другим химическим элементом. А фтор, имеющий на этой же внешней оболочке только 7 электронов, только и думает, как бы вступить и комбинацию с другим элементом, способным уступить ему 1 электрон для пополнения состава внешней оболочки до 8.
Н. — А как осуществляются такие супружеские сочетания?
Л. — Возьми для примера хлор, у которого на внешней оболочке М 7 электронов, и натрий, имеющий 2 электрона на оболочке К , 8 электронов на оболочке L и только 1 электрон на оболочке М . Вот тебе пример идеальной пары. Входя в комбинацию с хлором, натрий передает ему свой единственный электрон с внешней оболочки и доводит до 8 количество электронов на внешней оболочке. Одновременно с этим у натрия внешней станет оболочка L сo своими 8 электронами, принеся ему тем самым высокую стабильность (рис. 5).
Читать дальшеИнтервал:
Закладка:










