Фрэнсис Крик - Что за безумное стремленье! [litres]
- Название:Что за безумное стремленье! [litres]
- Автор:
- Жанр:
- Издательство:Литагент АСТ
- Год:2020
- Город:М.
- ISBN:978-5-17-115954-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Фрэнсис Крик - Что за безумное стремленье! [litres] краткое содержание
Что за безумное стремленье! [litres] - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Когда синтезируется белок, соответствующие аминокислоты соединяются вместе головным концом к хвостовому, выделяя молекулу воды и образуя длинную цепь, называемую полипептидной. Как я уже объяснял, строгий порядок аминокислот в данном белке, диктуемый генами, определяет его свойства. Наша задача – узнать, как укладывается каждая отдельная полипептидная цепочка в трехмерной структуре белка и как именно все боковые цепочки (некоторые из них до какой-то степени гибкие) располагаются в пространстве, чтобы понять, как работает белок. Брэгг и его коллеги пытались, строя модели, понять, способна ли основная полипептидная цепь дать один или несколько вариантов регулярной укладки. Полученные Астбери α- и β-типы рентгенограмм косвенно указывали на то, что способна.
Поэтому они работали только с полипептидным остовом и игнорировали его боковые цепочки. Может возникнуть вопрос, зачем вообще понадобилось строить модели, ведь простая химическая структура звена остова была определена надежно. Все расстояния между связями и углы между ними были известны. Однако вокруг так называемых одинарных связей возможно достаточно свободное вращение (и напротив, оно невозможно вокруг двойных связей), а точная конфигурация атомов в пространстве зависит от того, как расположены углы этого вращения. Это, в свою очередь, обычно зависит от взаимодействий между атомами на некотором расстоянии друг от друга вдоль цепочки, и здесь может быть несколько допустимых вариантов, особенно если эти связи слабые.
Причина этой гибкости может нуждаться в пояснении. Проще всего пояснить ее на примере вашей руки. Расположите ладонь так, чтобы все пальцы оказались в одной плоскости, а большой – точно под прямым углом к указательному. Вы можете двигать большим пальцем так, чтобы угол оставался прямым, но трехмерная форма руки при этом меняется (см. рис. на с. 99). Даже при том, что все ближайшие соседние расстояния (длина каждого пальца) неизменны, как и углы между ними. Только так называемый двугранный угол (между плоскостью четырех пальцев и плоскостью, в которой находятся большой и указательный пальцы) меняется. Примером «взаимодействия на малом расстоянии», о котором шла речь, будет перемена расстояния между кончиком большого пальца и кончиком мизинца.
В случае молекулы какие-то взаимодействия существовать должны, если молекуле необходимо принять определенную конфигурацию. Было очевидно, что наилучший способ скрепления полипептидной цепи – образовать водородные связи между определенными атомами остова. Водородные связи – слабый вид связей. Их энергия лишь в десяток раз превышает энергию теплового движения молекул (при комнатной температуре), поэтому отдельная водородная связь легко рвется при постоянном тепловом возбуждении. Это одна из причин, по которым вода жидкая при нормальной температуре и давлении. Водородная связь образуется между атомом-донором (плюс атом водорода, с которым он связан) и реципиентом. В полипептидной цепи единственный сильный донор – аминогруппа NH, а единственный возможный реципиент – кислород в группе CO (карбоксильной). Джон Кендрю указал, что такая водородная связь по сути дает кольцо атомов определенного вида. Вычислив все возможные кольца такого вида, можно вычислить и все возможные структуры этого типа, каждая из которых будет определяться связью аминогруппы NH с конкретной карбоксильной группой CO, например, отстоящей на три звена в цепочке. Эта связь будет повторяться снова и снова по всей длине цепи. Образованные таким путем множественные водородные связи помогают стабилизировать структуру, защищая ее от разрушительной силы теплового движения.
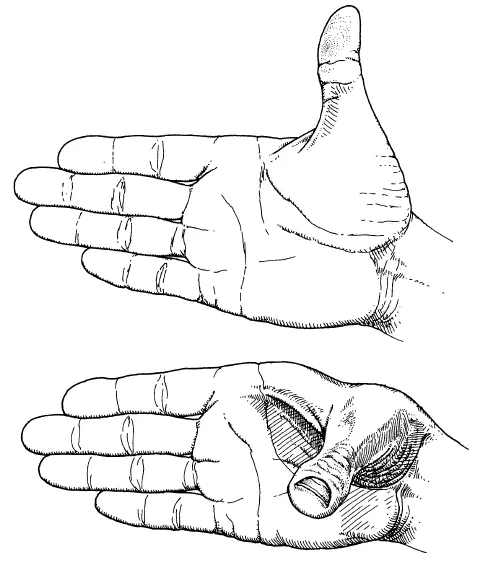
Показано, как можно поворачивать большой палец, чтобы изменить конфигурацию кисти, сохраняя все непосредственные углы и расстояния.
Используя металлические модели атомов с точным соблюдением масштабов связей, Брэгг, Кендрю и Перуц пытались смоделировать все возможные варианты укладки, отбрасывая лишь те, что были недостаточно компактны. Они надеялись, что какая-нибудь из моделей лучше подойдет для объяснения данных рентгенограмм, чем прочие. На беду, они не допустили для моделей наиболее благоприятных конфигураций. Астбери показал, что рентгенограмма α-типа дает яркую точку на так называемом меридиане, с шагом, соответствующим повтору вдоль оси волокна в 5,1 ангстрем. Это указывало, что какой-то существенный элемент структуры регулярно повторяется с таким интервалом и, возможно, это расстояние между соседними изгибами. Поскольку точка наблюдалась строго на меридиане, это указывало, что винтовая ось симметрии (элемент симметрии у правильной винтовой линии) имеет целочисленное значение, хотя и нельзя было понять какое. Брэгг допускал, что ось может быть двойной, тройной, четверной, даже пятеричной и более. Как уже говорилось, у куска обоев – двумерной последовательности повторяющегося рисунка – не бывает симметрии пятого порядка, но не предвиделось причин, по которым у отдельной полипептидной спирали не может быть пятеричной винтовой оси симметрии. Это всего-навсего означает, что, если повернуть спираль на 72 градуса (360/5) и одновременно сдвинуть ее структуру вдоль оси на определенное расстояние, она останется той же самой, если пренебречь тем, что произойдет на ее концах.
По этой причине Брэгг, Кендрю и Перуц строили все свои модели, исходя из целочисленных осей. Кроме того, их построения были несколько небрежны. Одну определенную группу атомов, так называемую пептидную группу, следовало в действительности рассматривать как плоскостную – все шесть ее атомов располагаются примерно в одной плоскости, – тогда как они допускали вращение вокруг пептидной связи, что делало их модели слишком вольными. Короче говоря, они сделали слишком жесткие ограничения для одного параметра (оси винтовой симметрии) и слишком мягкие – для другого (расположения пептидной связи на плоскости). Неудивительно, что все их модели выходили корявыми, и они не могли определить, какая лучше. Без особой охоты они опубликовали свои результаты в «Трудах Королевского общества», даже несмотря на их невнятность. Вышло так, что меня попросили вычитать гранки этой статьи (по-моему, гранки прислали в тот момент, когда все три соавтора отсутствовали в лаборатории), но я слишком плохо разбирался в тонкостях вопроса, чтобы понять, что именно было не так.
Мои коллеги не знали о том, что Лайнус Полинг следовал тому же подходу. В настоящее время он известен широкой публике главным образом в качестве пропагандиста витамина С. В то время он был, вероятно, ведущим химиком мира. Он первым применил квантовую механику в химии (объяснив по ходу дела, например, почему валентность углерода равна четырем) и был профессором химии в Калифорнийском технологическом институте, где руководил несколькими группами очень одаренных исследователей. Его особенно интересовало применение органической химии для объяснения ключевых биологических явлений.
Читать дальшеИнтервал:
Закладка:
![Обложка книги Фрэнсис Крик - Что за безумное стремленье! [litres]](/books/1068058/frensis-krik-chto-za-bezumnoe-stremlene-litres.webp)

![Фрэнсис Дворник - Центральная и Восточная Европа в Средние века [История возникновения славянских государств] [litres]](/books/1060850/frensis-dvornik-centralnaya-i-vostochnaya-evropa-v-s.webp)
![Фрэнсис Бернетт - Как стать леди [litres]](/books/1062547/frensis-bernett-kak-stat-ledi-litres.webp)
![Фрэнсис Хардинг - Свет в глубине [litres]](/books/1064022/frensis-harding-svet-v-glubine-litres.webp)

![Ольга Куно - Безумный рейс [litres]](/books/1084401/olga-kuno-bezumnyj-rejs-litres.webp)
![Елена Арсеньева - Проклятие безумной царевны [litres]](/books/1089949/elena-arseneva-proklyatie-bezumnoj-carevny-litres.webp)
![Фрэнсис Фицджеральд - Великий Гэтсби. Главные романы эпохи джаза [сборник litres]](/books/1143544/frensis-ficdzherald-velikij-getsbi-glavnye-romany.webp)
![Бриджид Кеммерер - Клятва безумная и смертельная [litres]](/books/1146697/bridzhid-kemmerer-klyatva-bezumnaya-i-smertelnaya-li.webp)
