Айзек Азимов - Краткая история химии. Развитие идей и представлений в химии.
- Название:Краткая история химии. Развитие идей и представлений в химии.
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Айзек Азимов - Краткая история химии. Развитие идей и представлений в химии. краткое содержание
Известный американский биохимик, популяризатор науки и писатель-фантаст А. Азимов знакомит читателя с предметом химии, историей возникновения и развития основных идей и представлений.
Краткая история химии. Развитие идей и представлений в химии. - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Период полураспада
Изучение строения атома привело к новому пониманию проблемы, но одновременно перед учеными встал ряд новых вопросов.
В 1900 г. Крукс (см. гл. 12) обнаружил, что свежеприготовленные соединения чистого урана обладают только очень незначительной радиоактивностью и что с течением времени радиоактивность этих соединений усиливается. К 1902 г. Резерфорд и его сотрудник английский химик Фредерик Содди (1877—1956) [125] высказали предположение, что с испусканием альфа-частицы природа атома урана меняется и что образовавшийся новый атом дает более сильное излучение, чем сам уран (таким образом, здесь учитывалось наблюдение Крукса). Этот второй атом в свою очередь также расщепляется, образуя еще один атом. Действительно, атом урана порождает целую серию радиоактивных элементов — радиоактивный ряд , включающий радий и полоний (см. разд. «Порядковый номер») и заканчивающийся свинцом, который не является радиоактивным. Именно по этой причине радий, полоний и другие редкие радиоактивные элементы можно найти в урановых минералах. Второй радиоактивный ряд также начинается с урана, тогда как третий радиоактивный ряд начинается с тория.
Уместно спросить, почему радиоактивные элементы, постоянно распадаясь, все же продолжают существовать? В 1904 г. этот вопрос разрешил Резерфорд. Изучая скорость радиоактивного распада, он показал, что после определенного периода, различного для разных элементов, распадается половина данного количества того или иного радиоактивного элемента. Этот период, характерный для каждого отдельного типа радиоактивного вещества, Резерфорд назвал периодом полураспада (рис. 22).
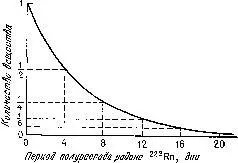
Рис. 22. Период полураспада радона определяют, измеряя через равные промежутки времени количество оставшегося вещества. Полученная зависимость представляет собой «затухающую» экспоненциальную кривую у=е -ах .
Период полураспада радия составляет, например, немногим менее 1600 лет. На протяжении геологических эпох любое количество радия в земной коре, конечно же, давно бы исчезло, если бы оно постоянно не пополнялось в результате распада урана. То же самое можно сказать и о других продуктах распада урана, в том числе и о таких, период полураспада которых измеряется долями секунды.
Период полураспада самого урана составляет 4 500 000 000 лет. Это громадный период времени, и за всю историю Земли распасться могла лишь часть первоначальных запасов урана. Торий распадается еще медленнее: его период полураспада составляет 14 000 000 000 лет.
Такие огромные промежутки времени можно определить только путем подсчета числа альфа-частиц, испускаемых данной массой урана (или тория). Резерфорд подсчитывал альфа-частицы, регистрируя небольшие вспышки, возникающие при соударении альфа-частиц с экраном из сульфида цинка (т. е. при помощи так называемого сцинтилляционного счетчика ).
Появление каждой новой альфа-частицы означало, что распался еще один атом урана, так что Резерфорд мог определить, сколько атомов распадается в секунду. Исходя из используемой им массы урана, Резерфорд определил общее число атомов урана. Располагая такими данными, было уже нетрудно рассчитать время, необходимое для распада половины имеющегося количества урана. Как выяснилось, речь идет о миллиардах лет.
Распад урана — настолько постоянный и характерный процесс, что его можно использовать для определения возраста Земли. В 1907 г. американский химик Бертрам Борден Болтвуд (1870—1927) предположил, что при такого рода определениях можно руководствоваться содержанием свинца в урановых минералах. Если предположить, что весь свинец в минералах появился в результате распада урана, то легко вычислить, сколько на это потребовалось времени. С помощью этого метода удалось определить, что возраст твердой земной коры исчисляется по крайней мере четырьмя миллиардами лет.
Тем временем Содди продолжал описывать изменения атома, вызываемые отдачей им субатомных частиц. Если атом теряет альфа-частицу (заряд +2), общий заряд его ядра уменьшается на два и элемент перемещается в периодической таблице на две клетки влево.
Если атом теряет бета-частицу (электрон с зарядом -1), то ядро приобретает дополнительный положительный заряд [126]и элемент перемещается в периодической таблице на одну клетку вправо. Если атом испускает гамма-лучи (незаряженные), то запас энергии при этом меняется, но состав частиц не затрагивается, так что он остается тем же самым элементом.
Руководствуясь этими правилами, химики смогли обстоятельно изучить многие радиоактивные ряды.
Изотопы
С открытием радиоактивных элементов перед учеными встала серьезная проблема: что делать с различными продуктами распада урана и тория? Их открывали десятками, а в периодической таблице оставалось максимум только девять мест (от полония с порядковым номером 84 до урана с порядковым номером 92), на которые их можно было бы поместить.
Так, атом урана (порядковый номер 92) испускает альфа-частицу. Порядковый номер нового элемента, согласно правилу Содди, 90. Это означает, что атом урана должен образовать атом тория. Однако период полураспада обычного тория измеряется 14 миллиардами лет, тогда как период полураспада тория, полученного из урана, составляет всего 24 дня.
Различия наблюдаются даже при получении нерадиоактивных элементов. Например, Ричардсу (специалисту по атомным массам, см. гл. 5) в 1913 г. удалось показать, что атомная масса свинца, полученного в результате распада урана, несколько отличается от атомной массы обычного свинца.
У Содди хватило решимости предположить, что одному и тому же месту в периодической таблице может соответствовать более одного вида атомов. Место номер 90 могут занимать различные разновидности тория, место номер 82 — различные разновидности свинца и т. д. Содди назвал эти разновидности атомов, занимающие одно и то же место в таблице, изотопами (от греческого tópos — место).
Изотопы, занимающие одно и то же место таблицы, должны иметь один и тот же порядковый номер и, следовательно, одно и то же число протонов в ядре и одно и то же число электронов на оболочках. Изотопы элемента должны обладать одинаковыми химическими свойствами, так как эти свойства зависят от числа и расположения в атомах электронов.
Но как в таком случае объяснить различие в радиоактивных свойствах и в атомных массах?
В прошлом веке Праут выдвинул свою знаменитую гипотезу (см. гл. 5), согласно которой все атомы составлены из водорода, так что все элементы должны иметь целочисленные атомные массы. Однако, как выяснилось, большинство атомных масс являются нецелочисленными, и этот факт, казалось, опровергал гипотезу.
Читать дальшеИнтервал:
Закладка: