Владимир Антонов - Эфир. Русская теория.
- Название:Эфир. Русская теория.
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Владимир Антонов - Эфир. Русская теория. краткое содержание
Эфир. Русская теория. - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
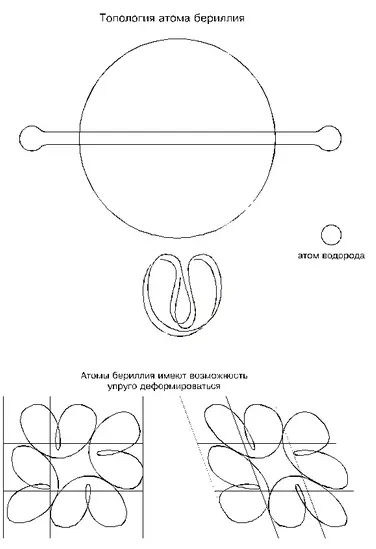
По своим физическим свойствам, как видно, бериллий сильно отличается от лития, но по топологии атомов они почти не различимы; отличие лишь в том, что атом бериллия как бы «сшит с запасом»: если атом лития напоминает тесный костюм школьника на взрослом человеке, то атом бериллия, наоборот, — просторный костюм взрослого на фигуре ребенка. Избыточная длинна шнура атома бериллия при одинаковой конфигурации его с литием образует более пологие очертания с радиусами изгибов, превышающими минимальные критические. Такой «запас» кривизны у атомов бериллия позволяет их деформировать вплоть до выхода на предел изгибов шнуров.
Топологическое сходство атомов лития и бериллия говорит о том, что четкой границы между ними нет; и невозможно сказать, какой наибольший размер имеет атом лития и какой наименьший — атом бериллия. Ориентируясь только на табличный атомный вес (а он усредняет все значения), можно считать, что шнур среднего по размерам атома бериллия состоит приблизительно из 16 500 связанных электронов. Верхний предел размеров атомов изотопов бериллия упирается в минимальный размер атома следующего элемента — бора, конфигурация которого резко отличается.
Запас по радиусам кривизны шнуров атомов бериллия сказывается в первую очередь на соединении их между собой в момент затвердевания металла: они примыкают друг к другу уже не короткими (точечными) участками как у лития, а длинными границами; контуры атомов как бы подстраиваются друг под друга, деформируясь и прилегая друг к другу максимально возможным образом; поэтому такие соединения очень прочны. Свою упрочняющую способность атомы бериллия проявляют и в соединениях с атомами других металлов, то есть в сплавах, в которых бериллий используется в качестве присадок к тяжелым металлам: заполняя пустоты и присасываясь своими гибкими желобами к атомам основного металла, атомы бериллия скрепляют их как клей, делая сплав очень прочным. Отсюда следует, что прочность металлов определяется длинами слипшихся участков присасывающих желобов атомов : чем длиннее эти участки, тем прочнее металл. Разрушение металлов происходит всегда по поверхности с самыми короткими слипшимися участками.
Запас по радиусам изгиба шнуров атомов бериллия позволяет им деформироваться без изменения соединений между собой; в результате деформируется все тело; это уже — упругая деформация. Упругая она потому, что в любом исходном состоянии атомы имеют наименее напряженные формы, а при деформации вынуждены терпеть некоторые «неудобства»; и стоит только деформирующей силе исчезнуть, как атомы возвратятся в свои исходные менее напряженные состояния. Следовательно, упругость металла определяется избытком длин шнуров его атомов, позволяющим их деформировать без изменения участков взаимного соединения .
С упругостью бериллия связана его жаропрочность; она выражается в том, что тепловые движения атомов могут происходить в пределах упругих деформаций, не вызывающих изменение соединений атомов между собой; поэтому в общем жаропрочность металла определяется , как и упругость, избытком длин шнуров его атомов . Снижение прочности металла при высоком нагреве объясняется тем, что тепловые движения его атомов уменьшают участки соединений их между собой; а когда эти участки полностью исчезают, происходит плавление металла.
Упругости бериллия сопутствует его хрупкость. Хрупкость может рассматриваться в общем случае как антипод пластичности: если пластичность выражается в возможности атомов изменять свои взаиморасположения с сохранением соединяющих участков, то хрупкость выражается, в первую очередь, в том, что у атомов такой возможности нет. Всякое взаимное смещение атомов хрупкого материала может происходить только при полном разрыве их связей; у этих атомов нет иных вариантов соединений. У упругих материалов (у металлов) хрупкость характеризуется еще и тем, что она — как бы прыгающая: возникшая в результате чрезмерных напряжений трещина с быстротой молнии распространяется по всему сечению тела. Для сравнения: кирпич под ударами молотка может крошиться (это — тоже хрупкость), но не раскалываться. «Прыгающая» хрупкость бериллия объясняется тем, что его атомы соединены между собой не лучшим образом, и все они напряжены; и стоит только нарушиться одной какой-то связи, как граничные атомы стремительно начнут «выпрямляться» в ущерб соединений со своими соседями; связи последних также начнут разрушаться; и этот процесс примет цепной характер. Следовательно, хрупкость упругих металлов зависит от степени деформаций соединенных между собой атомов и от отсутствия возможности изменения связей между ними .
Радиационная стойкость бериллия объясняется все тем же запасом в размерах его атомов: шнур атома бериллия имеет возможность спружинить под жестким радиационным ударом, не доходя до своей критической кривизны, и тем самым сохраниться неразрушенным.
И тем же можно объяснить светло-серый цвет бериллия и отсутствие у него яркого металлического блеска, такого, например, как у лития: световые волны эфира, падая на нежесткие шнуры поверхностных атомов бериллия, поглощаются ими, и только часть из волн отражается и создает рассеянный свет.
Плотность бериллия почти в четыре раза больше чем у лития только потому, что плотность шнуров его атомов выше: они соединяются между собой не в точках, а длинными участками. В то же время в сплошной своей массе бериллий — достаточно рыхлое вещество: он всего лишь в два раза плотнее воды.
4.5. Бор
Паспортные данные бора: он занимает пятую позицию в таблице Менделеева и относится к третьей группе периодической системы, то есть он — уже не металл; атомная масса бора 10,811; у него известны два изотопа с атомными массами 10 и 11; плотность бора2,3 грамма в кубическом сантиметре; температура плавления 2075 градусов Цельсия; бор предстает обычно в мелкокристаллическом виде.
Очень чистый бор бесцветен, однако чистым он практически никогда не бывает и поэтому выглядит чаще всего как темно-серый, бурый или даже как черный. В физическом и, особенно, в химическом отношениях бор очень сильно похож на своего соседа — на углерод: он также соединяется с кислородом, с серой, с азотом, с фосфором, с металлами; соединяются они и между собой. Все эти соединения нуждаются в «поджоге»; при обычной же температуре бор соединяется только со фтором. С азотом и углеродом бор образует сверхтвердые нитриды и карбиды, а с водородом — гидриды, которые по аналогии с углеводородами называют еще бороводородами. Бор может участвовать также в соединениях полимеров.
Читать дальшеИнтервал:
Закладка: