Разные - Журнал «ОТКРЫТИЯ И ГИПОТЕЗЫ», 2012 №2
- Название:Журнал «ОТКРЫТИЯ И ГИПОТЕЗЫ», 2012 №2
- Автор:
- Жанр:
- Издательство:ООО «Интеллект Медиа»
- Год:2012
- Город:Киев
- ISBN:Код 34840810
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Разные - Журнал «ОТКРЫТИЯ И ГИПОТЕЗЫ», 2012 №2 краткое содержание
КАК ГОВОРЯТ ДЕЛЬФИНЫ……………………………………………….2
Об эволюции ангелов……………………………………………………6
Летающие автомобили наступают…………………………………………..7
Откуда растут ноги у распространенных суеверий………………………………..8
ПРОТЕЗ ДЛЯ ВОСПОМИНАНИЙ…………………………………………..10
Найдено новое плотоядное растение………………………………………..14
Как ходят носороги…………………………………………………….14
Определен цвет Млечного Пути…………………………………………….15
Звезды нашей Галактики…………………………………………………15
Сказ о первом хакере…………………………………………………..16
Рука переучивает мозг………………………………………………….17
Многоклеточные дрожжи…………………………………………………17
ЗАГАДКИ ВСЕЛЕННОЙ……………………………………………….18
Найден чертеж Вавилонской башни…………………………………………22
Сумка Леонардо снова в моде……………………………………………..22
Цивилизация «золотых вождей»……………………………………………23
Второе упоминание о «конце света»…………………………………………23
КАШЕЛЬ. ЛЕЧИТЬ, ИЛИ НЕ ЛЕЧИТЬ?………………………………………24
Сколько ушей у паука?………………………………………………….31
Какого цвета инфузория-туфелька?…………………………………………31
Вакцина против кариеса…………………………………………………32
Скорость смерти……………………………………………………..32
Курительные рефлексы…………………………………………………33
Оборотная сторона креативности…………………………………………..33
ПОЧЕМУ РЖАВЕЕТ ГВОЗДЬ?…………………………………………….34
Удивительный кетчуп…………………………………………………..36
Десять основных геологических фактов………………………………………37
Спринтеры и стайеры…………………………………………………..38
Мозг, предсказывающий будущее…………………………………………..38
Разоблачение Джеймса Бонда…………………………………………….39
ХРАНИТЕЛИ КОСТЕЙ………………………………………………….40
Знаете ли вы, что……………………………………………………….46
На досуге…»……………………………………………………….48
Журнал «ОТКРЫТИЯ И ГИПОТЕЗЫ», 2012 №2 - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Благодаря защитным пленкам многие металлы неплохо выдерживают воздействие различных сред. Возьмем, к примеру, алюминиевую кастрюльку, в какой кипятят молоко или варят манную кашу.
Обычно такая кастрюлька не блестит, подобно хрому или нержавеющей стали, и имеет слегка белесый цвет. Дело в том, что на алюминии, как и на других металлах, на воздухе всегда образуется белесая оксидная пленка (оксид алюминия), которая отлично защищает металл от коррозии. Такие пленки называются пассивными, а металлы, на которых они самопроизвольно образуются, — пассивирующимися. Если же алюминиевую кастрюльку почистить металлической щеткой, налет исчезнет и появится металлический блеск. Но очень быстро поверхность вновь покроется пленкой оксида алюминия и станет белесой.
Перевести металл в пассивное состояние можно принудительным образом. Например, железо помимо незащитных гидроксида железа или же низших оксидов (закиси и закиси-окиси) при определенных условиях образует высший оксид — окись железа (Fe 2О 3). Этот оксид неплохо защищает металл и его сплавы при высоких температурах на воздухе, он же (одна из его форм) «ответственен», как считают специалисты, за пассивное состояние железных сплавов во многих водных средах.

Устойчивость нержавеющей стали в крепкой серной кислоте связана именно с пассивированием стали в этой весьма агрессивной среде. Если же поместить нержавейку в слабый раствор серной кислоты, сталь начнет корродировать.
Парадокс объясняется просто: крепкая серная кислота обладает сильными окислительными свойствами, благодаря чему на поверхности нержавеющей стали образуется пассивирующая пленка, а в слабой кислоте не образуется.
В случаях, когда агрессивная среда недостаточно «окислительная», используют специальные химические добавки, помогающие образованию на поверхности металла пассивной пленки. Такие добавки называют ингибиторами или замедлителями коррозии.
Не все металлы способны образовывать пассивные пленки, даже принудительно. В этом случае добавление в агрессивную среду ингибитора, напротив, удерживает металл в «восстановительных» условиях, в которых его окисление подавляется (оно энергетически невыгодно).
Искусственно поддерживать металл в «восстановительных» условиях можно и иным способом, ведь не всегда есть возможность добавить ингибитор. Возьмем, к примеру, обычное оцинкованное ведро. Оно сделано из углеродистой стали, а сверху покрыто слоем цинка. Цинк — более активный металл, чем железо, значит, он охотнее вступает в химические реакции. Поэтому цинк не просто механически изолирует стальное ведро от окружающей среды, но и «принимает огонь на себя», то есть корродирует вместо железа.
Похожим способом нередко защищают днища кораблей. Только их не покрывают сплошным слоем цинка, марганца или алюминия — это было бы очень дорого, да и сложно, а прикрепляют к днищу солидный кусок более активного металла (протектора). В итоге протектор разрушается, а днище корабля остается целым и невредимым.
Для подземных коммуникаций «восстановительные» условия создают с помощью электрохимической защиты: накладывают на защищаемый металл отрицательный (катодный) потенциал от внешнего источника тока, так что на металле прекращается процесс окисления.
Однако зачем нужно столько разных сложных способов защиты металлов? Разве нельзя просто покрасить металл или нанести на него эмаль?
Во-первых, все покрасить невозможно. А во-вторых… Возьмем для примера эмалированную кастрюлю или автомобиль. Если кастрюля, вырвавшись из рук, с грохотом упадет на пол и отшибет себе эмалированный бочок, то под отколовшейся эмалью будет зиять «черный глаз», края которого постепенно окрасятся в предательский рыжий цвет — скол покроется ржавчиной. Не лучшая судьба ждет и автомобиль, если вдруг в его лаковом боку (а чаще на стыке с днищем) образуется небольшая дырочка в слое лака. Этот канал поступления к корпусу агрессивных агентов — воды, кислорода воздуха, сернистых соединений, соли — немедленно заработает, и корпус начнет ржаветь. Вот и приходится владельцам автомобилей делать дополнительную антикоррозионную обработку.
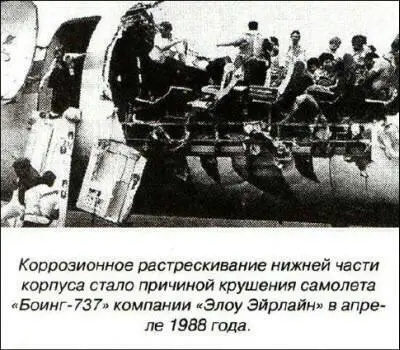
Так, может, проблема коррозии металлов решена? Увы, не все так просто. Любые коррозиестойкие сплавы устойчивы только в определенных средах и условиях, для которых они разработаны. Например, большинство нержавеющих сталей отлично выдерживают кислоты, щелочи и очень «не любят» хлориды, в которых они часто подвергаются местным видам коррозии — язвенной, точечной и межкристаллитной. Это очень коварные коррозионные разрушения. Конструкция из красивого, блестящего металла без намека на ржавление может однажды рухнуть или рассыпаться. Все дело в мельчайших точечных, но очень глубоких поражениях. Или же в микротрещинах, не видимых глазом на поверхности, но пронизывающих буквально всю толщу металла. Не менее опасно для многих сплавов, не подверженных общей коррозии, так называемое коррозионное растрескивание, когда внезапно конструкцию пронизывает огромная трещина. Такое случается с металлами, испытывающими длительные механические нагрузки — в самолетах и вертолетах, в различных механизмах и строительных конструкциях.

Крушение поездов, падение самолетов, разрушение мостов, выбросы газа и разливы нефти из трубопроводов — причиной подобных катастроф нередко становится коррозия. Чтобы ее укротить, предстоит еще много узнать о сложнейших природных процессах, происходящих вокруг нас.
 Т. Зимина, к-т химических наук
Т. Зимина, к-т химических наук
УДИВИТЕЛЬНЫЙ КЕТЧУП
Группа физиков под руководством Сяна Чэна из Корнеллского университета (США) обнаружила, что высокая вязкость кетчупа, краски и других тягучих жидкостей возникает из-за хаотичного движения частиц и крупных молекул в их составе. Если такую жидкость размешать или встряхнуть, то быстрые молекулы воды или других растворителей увлекают за собой тяжелые частицы и «подавляют» броуновское движение, из-за чего их густота уменьшается.
Читать дальшеИнтервал:
Закладка:










