Айзек Азимов - Земля и космос. От реальности к гипотезе
- Название:Земля и космос. От реальности к гипотезе
- Автор:
- Жанр:
- Издательство:Центрполиграф
- Год:2004
- Город:Москва
- ISBN:5-9524-0899-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Айзек Азимов - Земля и космос. От реальности к гипотезе краткое содержание
Как появилась астрология и есть ли в ней рациональное зерно? Что такое «редкие земли»? Сколько времени будет продолжаться современный рост населения Земли и как можно решить демографическую проблему? Вы сможете получить ответы на эти и многие другие вопросы из области астрономии, физики, химии и социологии, прочитав эту познавательную и увлекательную книгу.
Земля и космос. От реальности к гипотезе - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Это говорит о том, что полагаться только на атомные массы нельзя. Требуются еще какие-либо свойства, и лучше всего, если эти свойства будут представлены целыми числами, чтобы, переходя, скажем, от 1 к 2 и от 2 к 3, мы знали, что между ними ничего нет.
Первые результаты такого подхода появились в 1852 году. Английский химик Эдуард Франкланд заметил, что в химических формулах, которые были созданы к этому времени, один атом одного элемента, похоже, всегда связан с фиксированным числом атомов других элементов.
Таким образом, атом водорода никогда не связан более чем с определенным числом атомов другого вещества. Это можно назвать степенью комбинирования единицы (или валентностью, от латинского слова, обозначающего «степень»). Атом кислорода может комбинироваться с двумя атомами водорода, атом азота с тремя атомами, а атом углерода — с четырьмя, так что кислород, азот и углерод имеют валентности в 2, 3 и 4 соответственно. Эти валентности работают очень четко. Таким образом, атом углерода (валентность 4) может комбинироваться с двумя атомами кислорода (2 + 2) или с одним атомом кислорода и двумя атомами водорода (2 + 1 + 1).
Концепция валентности не только отличается простотой, ясностью и явной полезностью, но и вводит целые числа, поскольку валентностей 1,5 или 2,32 — или какой-либо в этом духе — не существует. (В действительности наука XX века дала новую концепцию, которая в самом деле ввела что-то вроде дробных валентностей, но это не влияет на систему доказательств в данной главе. — Примеч. авт. )
В 1869 году русский химик Дмитрий Иванович Менделеев попытался организовать элементы согласно молекулярной массе и валентности. Результатом стала система, очень упрощенную и неполную версию которой я привожу в таблице 1 с атомными весами, округленными до одной десятой после запятой.
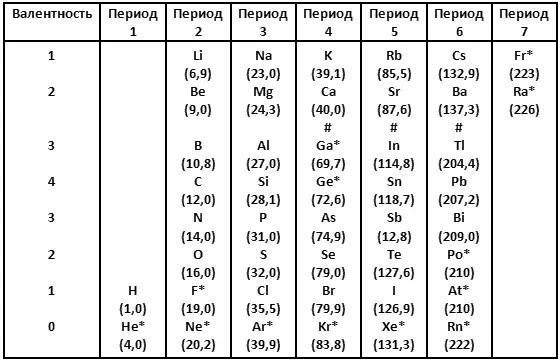
В таблице 1 я даю химические элементы так, чтобы сэкономить место; это не повлияет на систему доказательств и ни в коей мере не запутает, даже если вы не знаете, каким символом какой элемент обозначен. Когда мне придется упомянуть определенный элемент, я дам его полное название, вместе с символом.
Строки в таблице 1 содержат тесно связанные семейства элементов. К примеру, верхняя строка содержит литий (Li), натрий (Na), калий (К), рубидий (Rb), цезий (Cs) и франций (Fr), которые имеют одинаковые свойства. Эти элементы медленно плавятся, исключительно активны и при определенных условиях реагируют примерно одинаково. Более того, там, где различия существуют, они проявляют себя постоянным изменением вдоль строки. От лития к натрию, калию и так далее точка плавления вещества становится ниже, а активность его возрастает. Эти шесть элементов называют щелочными металлами.
Вторая строка содержит шесть щелочноземельных элементов, которые тоже имеют сходные свойства. И так далее на протяжении таблицы.
Заметим, что в периоде 5 теллур (Те) идет перед йодом (I), хотя теллур имеет большую атомную массу, а значит, должен находиться после йода, если бы классификация шла только по атомной массе.
Именно Менделееву принадлежит великая заслуга в том, что валентность (как и химические свойства в целом) стала учитываться в первую очередь по отношению к атомной массе. Для того чтобы поместить теллур и йод в надлежащее семейство с надлежащей валентностью, пришлось поменять порядок следования атомной массы. Более сложное знание атомной структуры, обретенное химиками в дальнейшем, доказало, что в этом отношении интуиция Менделеева оказалась абсолютно правильной.
Когда мы перемещаемся вниз по списку элементов согласно их молекулярной массе, периодически повторяется определенный набор свойств — по этой причине этот список, организованный так, что определенные наборы укладываются точно в строки или колонки, называются периодической таблицей.
В то время, когда Менделеев впервые выдвинул свою Периодическую систему, значительное число элементов, приведенных в таблице 1, еще не было открыто. Они указаны в таблице 1 звездочкой.
К примеру, шесть элементов в строке внизу — гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn) — не были известны в 1869 году. Об их существовании совершенно не представляли, и без них Периодическая система, казалось, имела законченный вид. Если идти последовательно сверху вниз в порядке атомных весов элементов, то изменение валентности в таблице 1 происходит (если исключить нижний ряд) по следующему порядку: 1, 1, 2, 3, 4, 3, 2, 1, 1, 2, 3, 4, 3, 2, 1, 1, 2 и так далее.
Однако, когда были открыты элементы в нижней строке, оказалось, что они не вступают в соединения с любыми другими элементами и, следовательно, имеют нулевую валентность. Таким образом, последовательность валентностей изменилась на следующую: 1, 0, 1, 2, 3, 4, 3, 2, 1, 0, 1, 2, 3, 4, 3, 2, 1, 0, 1, 2 и так далее.
Элементы нижней строки, имеющие схожие свойства и называемые инертными газами, или благородными газами, просто расширили таблицу, но не нарушили ее порядок. Наоборот, введение 0 в надлежащем месте сделало таблицу даже «элегантнее». Тот факт, что эта весьма неожиданно обнаруженная группа элементов столь превосходно вписалась в Периодическую систему, послужил дополнительным доказательством концепции Менделеева.
Для того чтобы сохранить аргон (Ar) на своем правильном месте в семействе инертных газов, его следует поставить перед калием (K), даже хотя это меняет порядок следования по молекулярным массам. И снова это повторилось в таблице с теллуром (Te) и йодом (I).
Заметим также, что в таблице 1 пять элементов с самыми большими атомными массами были неизвестны во времена Менделеева. Это полоний (Po), астат (At), радон (Rn), франций (Fr) и радий (Ra). Эти элементы были обнаружены в 1890-х и в последующие годы; они являются радиоактивными. Все эти элементы относятся к нестабильным и присутствуют в земной коре в очень малых количествах. Поскольку все они располагаются в конце таблицы, их отсутствие не влияло на все остальные.
Затем возник фтор (F), который, строго говоря, не был хорошо изучен во времена Менделеева. Это очень своеобразный элемент. Фтор был обнаружен в различных соединениях, из которых его извлечь не удавалось. Свойства фтора были известны, но на основании свойств его соединений. Его связи в соединениях оказались столь тесны, что только в 1886 году химики смогли выделить фтор из соединений, чтобы исследовать этот элемент в чистом виде. Даже малоизученный, фтор присутствовал в таблице с самого начала (это напоминает ситуацию с глобусом, северные и южные поля которого были обозначены, даже несмотря на то, что полюсов достигнуть пока не удалось).
Читать дальшеИнтервал:
Закладка:







![Айзек Азимов - Земля Ханаанская. Родина иудаизма и христианства[The Land of Canaan]](/books/447636/ajzek-azimov-zemlya-hanaanskaya-rodina-iudaizma-i-h.webp)

