Михаил Левицкий - Карнавал молекул. Химия необычная и забавная
- Название:Карнавал молекул. Химия необычная и забавная
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2019
- Город:Москва
- ISBN:978-5-0013-9101-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Левицкий - Карнавал молекул. Химия необычная и забавная краткое содержание
В книге рассказано о некоторых драматичных, а, порой, забавных поворотах судьбы как самих открытий, так и их авторов. Кроме того, читатель потренируется в решении занятных задач, что особенно приятно, когда рядом помещена подсказка, а потом и сам ответ.
В отличие от учебника в книге нет последовательного изложения основ химии, поэтому ее можно читать, начиная с любой главы.
Карнавал молекул. Химия необычная и забавная - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Большинство названий сложилось исторически, для их обозначения широко применяют трехбуквенные сокращения: глицин – ГЛИ, аланин – АЛА и т. д. В международной практике их обозначают с помощью латинских трехбуквенных сокращений: например, глицин – Gly, аланин – Ala и др.
Белковая молекула образуется в результате последовательного соединения аминокислот, при этом карбоксильная группа – COOH взаимодействует с аминогруппой – NH 2соседней молекулы, в результате образуется пептидная связь – CO – NH– и выделяется молекула воды. На рисунке 5.9 показано последовательное соединение аланина, валина и глицина.
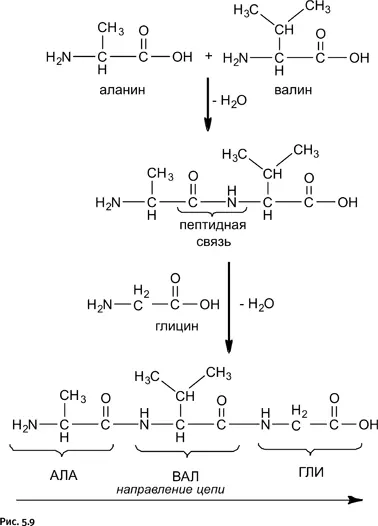
Из этой схемы следует, что при любом количестве соединяемых аминокислот на одном конце возникшей цепочки обязательно будет находиться аминогруппа – NH 2, а на другом – карбоксильная группа – C(O)OH. Таким образом, вместо структурной формулы мы можем использовать сокращенное обозначение получившегося соединения: АЛА-ВАЛ-ГЛИ. Поскольку количество аминокислот, используемых природой, всего 20, то подобные сокращения позволяют компактно записать формулу любого белка и никакой неясности при этом не возникает.
Молекула инсулина, как установил Ф. Сенгер, состоит из 51 аминокислотного остатка (это один из самых короткоцепных белков) и представляет собой две соединенные между собой цепи неодинаковой длины. На рисунке 5.10 показан порядок чередования аминокислотных фрагментов, обозначенных трехбуквенными сокращениями.
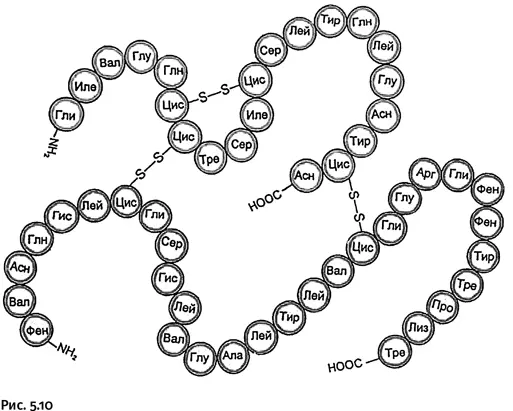
Обратите внимание: содержащиеся в цепи остатки аминокислоты цистеина (сокращенное обозначение ЦИС) образуют дисульфидные мостики – S – S–, которые связывают две полимерные молекулы и, кроме того, образуют перемычку внутри одной цепи. При таком компактном изображении белковой молекулы символы химических элементов используют только для обозначения дисульфидных мостиков и концевых групп (NH 2и COOH).
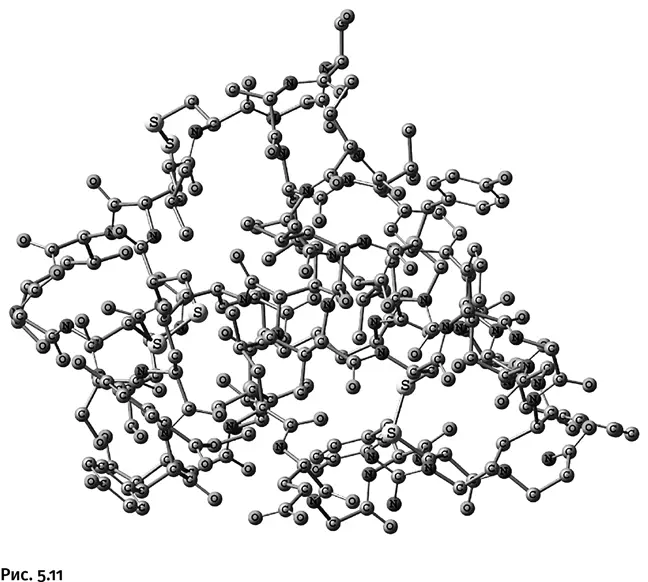
Для сравнения рассмотрите структурную формулу инсулина в виде объемной шаростержневой модели (рис. 5.11).
От демонтажа – к сборке
Казалось бы, после того как установлена структура молекулы, синтезировать ее заново не составит большого труда. Если какая-либо деталь собрана на резьбовых соединениях, то разобрать и собрать ее несложно, нужны лишь отвертка или гаечный ключ. Но если изделие представляет собой отливку или это сварное изделие, то разобрать (разрезать или распилить), а затем собрать его вновь совсем не просто. В этом случае разборка и сборка (по способам решения) совершенно разные задачи.
Основная трудность при сборке белковой молекулы – добиться, чтобы необходимые аминокислоты соединялись строго в намеченном порядке. Так как каждая аминокислота может реагировать не только с другой аминокислотой, но и сама с собой, то в итоге может получиться молекула, не имеющая ничего общего с тем, что синтезирует живой организм.
К моменту, когда решался вопрос о синтезе инсулина, было разработано несколько соответствующих методик. Чтобы аминокислота, которую необходимо присоединить к растущей цепи, не реагировала сама с собой, ее реакционноспособные концы (аминогруппу NH 2и карбоксильную группу СООН) блокировали специальным образом: карбоксильную группу переводили в п -нитрофениловый эфир NO 2C 6H 4O–, а со стороны аминогруппы присоединяли карбоксибензильную группу – C(O)CH 2C 6H 5. Такая блокированная с двух сторон молекула не может реагировать сама с собой, но зато она может реагировать со свободной аминогруппой, находящейся на конце растущей цепи, при этом «левая» блокировка удаляется в виде NO 2C 6H 4OН (рис. 5.12).
На схеме (рис. 5.13) показано, что к растущей цепи, имеющей на конце фрагмент аланина (АЛА), присоединяется молекула глицина (ГЛИ), в результате растущая цепь удлиняется на одно звено. Однако теперь на конце цепи разместилась блокирующая карбоксибензильная группа – C(O)CH 2C 6H 5. Из показанной выше схемы следует, что цепь наращивают аминокислотой со стороны «аминного хвоста» этой цепи, который оказался теперь заблокированным. Следовательно, нужно сделать этот «аминный хвост» реакционноспособным, т. е. перевести его в активную форму, что осуществляли обработкой бромоводородом с уксусной кислотой, блокировка при этом удаляется в виде Br-CH 2C 6H 5по схеме (рис. 5.13).
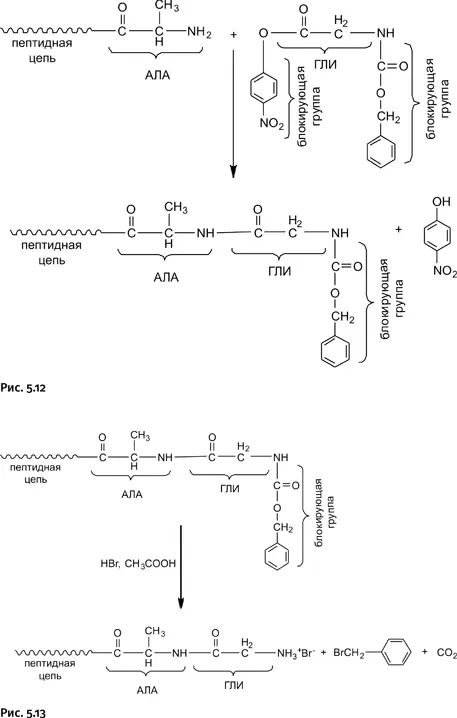
В результате аминогруппа на конце цепи (она показана в виде аммониевой соли с HBr) вновь готова реагировать с очередной аминокислотой (естественно, тоже содержащей блокирующие группы). Параллельно были разработаны и другие методы сборки полиамидных цепей.
Штурм вершины
К полному синтезу инсулина в 1962 г. приступили практически одновременно три группы исследователей: группа Катосоянниса из Питтсбурга, США (рис. 5.14), группа Г. Цана из Аахена, Германия (рис. 5.15), а также группа китайских химиков из Шанхая и Пекина. Все три группы действовали по весьма похожим стратегиям: собрали отдельно короткую и длинную цепь из заготовленных фрагментов, а затем соединяли обе цепи дисульфидными мостиками.

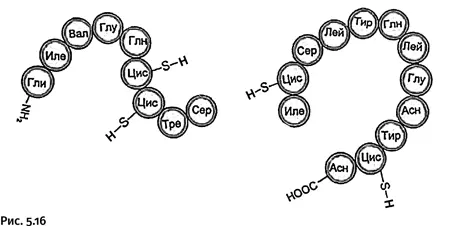
Короткую цепь все три группы химиков монтировали одинаково, из одних и тех же двух блоков (рис. 5.16).
Длинную цепь составляли из четырех фрагментов, однако перед синтезом необходимо было решить, из каких именно блоков ее следует собирать, и потому длинную цепь мысленно «разрезали», но места разреза каждая группа намечала по-своему. Различия возникли из-за того, что неодинаковы были и методы соединения блоков, и методы промежуточной защиты, используемые каждой из групп.
Естественно, на последнем этапе у всех авторов получились одинаковые молекулы. Приблизительно год ушел на создание исходных блоков. Подстегиваемая обстановкой соревнования аахенская группа интенсифицировала работу и в декабре 1963 г. сообщила об успешном синтезе инсулина. Эта группа буквально вырвала первенство у питтсбургских химиков, которые сообщили об успешном результате в марте 1964 г. Окончательный выход чистого продукта колебался в пределах 0,02–0,07 %. У китайских химиков выход был несколько выше (1,2–2,5 %), но, разумеется, о производстве инсулина по таким методикам не могло быть и речи.
Читать дальшеИнтервал:
Закладка:









