Коллектив авторов - Популярная библиотека химических элементов. Книга первая. Водород — палладий
- Название:Популярная библиотека химических элементов. Книга первая. Водород — палладий
- Автор:
- Жанр:
- Издательство:Наука
- Год:1983
- Город:М.
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Коллектив авторов - Популярная библиотека химических элементов. Книга первая. Водород — палладий краткое содержание
содержит сведения обо всех элементах
известных человечеству. Сегодня их 107
причем некоторые получены искусственно.
Как неодинаковы свойства каждого из «кирпичей мироздания», так же неодинаковы их истории и судьбы. Одни элементы, такие
как медь, железо,
известны с доисторических времен. Возраст других измеряется только веками
несмотря на то, что ими, еще не открытыми, человечество пользовалось
незапамятные времена. Достаточно вспомнить о кислороде, открытом лить в
веке. Третьи открыты
лет назад
но лишь в наше время приобрели первостепенную важность. Это уран, алюминий, бор, литий, бериллий. У четвертых, таких, как, например, европий и скандий, рабочая биография только начинается. Пятые получены искусственно методами ядерно-физического синтеза
технеций, плутоний, менделевий
курчатовий… Словом
сколько элементов, столько индивидуальностей, столько историй
столько неповторимых сочетаний свойств.
В первую книгу вошли материалы о 46 первых, по порядку атомных номеров, элементах, во вторую
обо всех остальных.
Популярная библиотека химических элементов. Книга первая. Водород — палладий - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Разумеется, соединения криптона и других благородных газов получить не легко. Так, кристаллический KrF 2был получен в результате воздействия тихого электрического разряда на смесь из фтора, криптона и аргона в молярном отношении 1 : 70 : 200. Условия реакции: давление — 20 мм ртутного столба, температура — минус 183°С.
Свойства дифторида криптона достаточно обычны: при комнатной температуре он неустойчив, но при температуре сухого льда (— 78°С) его можно хранить очень долго. И не только хранить, а и исследовать взаимодействие этих бесцветных кристаллов с другими веществами. Дифторид криптона — весьма активный окислитель. Он вытесняет хлор из соляной кислоты и кислород из воды. Реагируя с органическими соединениями, он не только окисляет их — иногда при этом происходит замена хлора на фтор в органической молекуле. Впрочем, многие органические вещества, например этиловый спирт, от соприкосновения с дифторидом криптона воспламеняются. Через фторид криптона получены соединения этого элемента с переходными металлами; во всех этих соединениях есть и фтор. Общая формула таких соединений KrF +MeF 6 -. Исключения составляют соединения мышьяка и сурьмы: Kr 2F 3 +AsF 6 -, Kr 2F 3 +SbF 6 -и KrF +Sb 2F 6 -. В реакциях с дифторидом криптона как очень сильным окислителем были получены некоторые уникальные неорганические соединения — пентафторид золота AuF 5, гептафторид брома BrF 7, перброматы.
Извлечение из воздуха
Криптон получают из воздуха. Но чтобы получить литр элемента № 36, приходится переработать более миллиона литров воздуха. Тем не менее современные масштабы производства кислорода позволяют попутно извлекать довольно значительное и с каждым годом возрастающие количества криптона.
Как наименее летучие компоненты воздуха, криптон и ксенон скапливаются в самой «теплой» части воздухоразделительного аппарата вместе с жидким кислородом. Из него-то и выделяют элемент № 36.
Ожиженную кислородную фракцию направляют в ректификационную колонну, нижняя часть, или «пристройка», которой (конденсатор) охлаждается жидким азотом. Здесь получается «бедный» криптоновый концентрат, содержащий 0,1–0,2% Kr; этот «бедняк» в 400 раз богаче криптоном, чем исходный кислород.
Прежде чем продолжить ректификацию, «бедный» концентрат очищают от метана, ацетилена и прочих углеводородов. Такая операция необходима, чтобы исключить опасность взрыва на последующих стадиях отделения криптона. Микропримеси углеводородов в воздухе есть всегда. Причины их появления: испарение нефтепродуктов, утечка природного газа, бактериальный распад органических остатков и, наконец, промышленные выбросы.
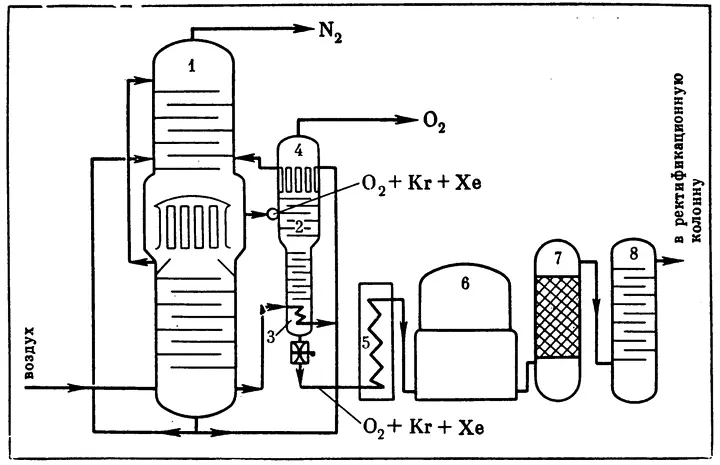
Схема извлечения криптона и ксенона из воздуха. Эти газы получают как ценные побочные продукты при разделении воздуха. Цифрами обозначены: 1 — основной аппарат для разделения воздуха на кислород и азот (он состоит из сочлененных ректификационных колонн: конденсатор нижней колонны служит испарителем верхней); 2 — дополнительная колонна для отделения криптона и ксенона; 3 — испаритель дополнительной колонны 4 — дефлегматор (конденсатор) дополнительной колонны; 5 — испаритель, в который из колонны — поступает кубовая жидкость, обогащенная Kr и Xe; 6 — газгольдер; 7 — контактный аппарат, в котором выжигают углеводороды; 8 — абсорбер для поглощения CO 2. Из последней ректификационной колонны выходит газовая смесь, в которой 50–75% криптона и ксенона
В контактных аппаратах при 700°С в присутствии катализатора — CuO или Al 2O 3— большая часть углеводородов выгорает. Очищенную смесь кислорода и криптона снова превращают в жидкость и отправляют во вторую ректификационную колонну. Здесь получают уже богатый концентрат — в нем 10–20% криптона. Но параллельно опять возрастает содержание углеводородов. И опять смесь переводится в газообразное состояние, и опять следует выжигание углеводородов. Затем весь этот цикл повторяется еще раз.
Окончательная криптоно-ксеноновая смесь содержит 90–98% Кr+Хe. Для тонкой очистки этой смеси остатки кислорода связывают водородом в воду, а примесь азота удаляют, пропуская смесь над стружками магния, — азот реагирует с ним, образуя нитрид.
Последний этап — разделение криптона и ксенона. Жидкую смесь опять превращают в газ и направляют в адсорбер с активированным углем. Здесь при температуре 65–75°С ксенон и некоторое количество криптона поглощаются углем, а выходящий из адсорбера газ содержит по меньшей мере 97% криптона.
«Светить всегда»
Производство электроламп — главный потребитель криптона. Небольшие грибовидные лампы с криптоновым (или криптоноксеноновым) наполнением постепенно теснят лампы аргоноазотного наполнения, которые в свое время вытеснили пустотные и азотонаполненные лампы.
Достоинства криптона в лампах накаливания очевидны: он 2 в 2,1 раза тяжелее аргона и почти вдвое хуже проводит тепло. В более плотном газе замедляется распыление раскаленной вольфрамовой нити — это увеличивает стабильность светового потока. Малая же теплопроводность криптона способствует увеличению доли видимого излучения в общем потоке лучистой энергии. Криптоновое наполнение в сравнении с аргоновым повышает мощность ламп на 5–15% и сроки службы на 40–170%. Вдобавок наполовину уменьшается объем колбы.
Криптоном заполняют и газосветные трубки низкого давления — преимущественно рекламные. Используют этот газ и в конструкциях ламп высокого давления. Яркий белый (с розоватым оттенком) свет таких ламп нужен в лакокрасочной и текстильной промышленности, при освещении сцен телевизионных студий, при киносъемках. Некоторые из таких ламп служат мощными источниками инфракрасного излучения.
Главное назначение криптона сегодня — «светить всегда, светить везде до дней последних донца…»
САМАЯ ПОСТОЯННАЯ. Еще недавно эталоном метра был платино-иридиевый стержень, хранящийся в Севре близ Парижа. Но с течением времени росла необходимость в точности линейных измерений. Драгоценная палка как эталон уже не удовлетворяла, и в 1960 г. заключили международное соглашение, определяющее метр, как 1 650 763,73 длины волны в вакууме излучения, соответствующего оранжевой линии стабильного изотопа криптон-86.
КРИПТОН — В ЗЕМЛЮ. Развитие ядерной энергетики обострило вопрос захоронения радиоактивных отходов, в том числе и криптона-85. Чтобы исключить выброс его в атмосферу и связанную с этим радиационную опасность, предложено закачивать этот газ под землю в пористые породы. Для этой цели пригодны, в частности, пласты выработанных газовых месторождений. Этот способ применяют на практике с середины 50-х годов.
Читать дальшеИнтервал:
Закладка:










