Коллектив авторов - Популярная библиотека химических элементов. Книга первая. Водород — палладий
- Название:Популярная библиотека химических элементов. Книга первая. Водород — палладий
- Автор:
- Жанр:
- Издательство:Наука
- Год:1983
- Город:М.
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Коллектив авторов - Популярная библиотека химических элементов. Книга первая. Водород — палладий краткое содержание
содержит сведения обо всех элементах
известных человечеству. Сегодня их 107
причем некоторые получены искусственно.
Как неодинаковы свойства каждого из «кирпичей мироздания», так же неодинаковы их истории и судьбы. Одни элементы, такие
как медь, железо,
известны с доисторических времен. Возраст других измеряется только веками
несмотря на то, что ими, еще не открытыми, человечество пользовалось
незапамятные времена. Достаточно вспомнить о кислороде, открытом лить в
веке. Третьи открыты
лет назад
но лишь в наше время приобрели первостепенную важность. Это уран, алюминий, бор, литий, бериллий. У четвертых, таких, как, например, европий и скандий, рабочая биография только начинается. Пятые получены искусственно методами ядерно-физического синтеза
технеций, плутоний, менделевий
курчатовий… Словом
сколько элементов, столько индивидуальностей, столько историй
столько неповторимых сочетаний свойств.
В первую книгу вошли материалы о 46 первых, по порядку атомных номеров, элементах, во вторую
обо всех остальных.
Популярная библиотека химических элементов. Книга первая. Водород — палладий - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
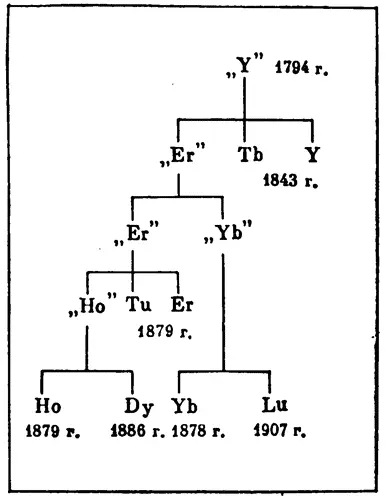
Окись иттрия, выделенная из гадолинита, в действительности оказалась смесью окислов нескольких элементов. Больше ста лет продолжалось «расщепление» иттрия на все новые и новые элементы. Основные этапы этого «расщепления» отражены на диаграмме
Иттрий плотно заперт в кристаллической решетке минерала и вырвать его оттуда далеко не просто. Правда, сейчас уже во многих странах налажено попутное извлечение иттрия при переработке цериевых, урановых и ториевых руд; как источник элемента № 39 используют бастнезит и некоторые минералы самого иттрия, прежде всего ксенотим. Но во всех случаях извлечение этого металла — дело трудное и долгое.
Вот как, к примеру, получают иттрий из ксенотима.
Казалось бы, просто. Формула минерала — YPO 4. Давно известно, что лучше всего восстанавливать иттрий из его галогенидов. Значит, нужно провести обменную реакцию: вместо фосфата иттрия получить фторид или хлорид, а затем восстановить его. Всего две производственных стадии — чего проще!
Но просто все лишь на бумаге. В действительности в ксенотиме, уже обогащением на магнитном сепараторе, всего 36% Y 2O 3(в виде фосфата) и 24% окислов других редкоземельных элементов. И здесь мешает ставшая уже притчей во языцех общность всех этих элементов.
«Вскрывают» минерал, обрабатывая его серной кислотой при высокой температуре. Полученный раствор подают на ионообменную колонну, заполненную катионообменной смолой. Избирательная способность катионита не слишком высока: он принимает почти все трехвалентные положительно заряженные ионы. Значит, на этой стадии иттрий отделяется лишь от «неродственных» элементов, а редкоземельные остаются в колонне вместе с ним.
Чтобы «смыть» иттрий с катионита, через колонку начинают пропускать элюент — раствор этилендиаминтетрауксусной кислоты. Такой «душ» полезен потому, что на этой стадии образуются комплексные соединения иттрия и других редких земель, отличающиеся одно от другого больше, чем классические соединения этих элементов, отчего ионы иттрия и ионы прочих редкоземельных элементов удерживаются катионитом с неодинаковой силой. Значит, в разных фракциях элюента будут преобладать уже разные элементы.
Отобрав иттриевую фракцию и подвергнув ее дополнительной очистке, на нее воздействуют щавелевой кислотой и получают оксалат иттрия. Его прокаливают, превращая в окись. Этим способом на 12 колоннах (высотой 3 и диаметром 0,75 м) за месяц получают чуть больше 100 кг Y 2O 3. Впрочем, считать месячную производительность неразумно: процесс длится два месяца. Выход 99,9%-ной окиси иттрия за два месяца — 225 кг.
Еще раз напомним, что описанная схема — одна из многих; чаще всего окись иттрия получают из бастнезита совсем другим путем.
Окись иттрия находит самостоятельное применение. Известно, что она, как и окись скандия, входит в состав ферритов — элементов памяти электронно-вычислительных машин.
От окисла к металлу
После того как иттрий отделен от основной массы редкоземельных элементов, его нужно восстановить. Для этого окись превращают в один из галогенидов иттрия, например, во фторид:
Это соединение смешивают с дважды перегнанным металлическим кальцием, помещают все в танталовый тигель и закрывают перфорированной крышкой. Тигель отправляют в кварцевую индукционную печь. Печь закрывают, откачивают из нее воздух и начинают медленно нагревать. Когда температура достигнет 600°C, в печь пускают аргон, а прекращают его подачу, когда давление в печи достигнет 500 мм ртутного столба. Затем температуру повышают до 1000°C, и восстановление начинается. Реакция 2YF 3+ 3Ca → 2Y + 3CaF 2— экзотермическая, и температура в печи продолжает расти. Тогда еще «поддают жару», доводят температуру до 1600°C (в этих условиях лучше разделяются металл и шлак), после чего дают печи остыть.
Шлак легко откалывается, и остается слиток иттрия чистотой до 99%. Примесь кальция без труда удаляется вакуумной переплавкой; труднее избавиться от тантала (0,5–2%) и кислорода (0,05–0,2%). Но и это можно сделать и получить слитки, пригодные для промышленного использования и для уточнения физико-химических характеристик элемента № 39/
Рассказывая о свойствах иттрия, обороты «только один» или «только одна» можно применить лишь дважды.
Во-первых, для этого элемента неприменимо такое общее, казалось бы, понятие, как «природная смесь изотопов». Нет у него природной смеси: весь естественный иттрий — это только один стабильный изотоп иттрий-89.
И только одну валентность (3+) проявляет иттрий во всех известных соединениях. Но, возможно, это утверждение не есть «истина в последней инстанции». Сложности получения элементного иттрия и высокая цена (килограмм иттрия еще недавно стоил 440 долларов) в течение многих лет сдерживали исследования элемента № 39 и его соединений. Поэтому не исключено, что когда-нибудь будут получены соединения иттрия с «нестандартной» валентностью, как это случилось, например, с алюминием. Ведь во времена, когда алюминиевая посуда была привилегией королей, ни один химик не подозревал о существовании соединений одновалентного алюминия.
Не только перспективы
Иттрий долго ходил в «перспективных». Еще в книгах, изданных в начале 60-х годов нашего века, этот металл считали перспективным и не больше. Так, во втором издании известного английского справочника «Rare Metalls Handbook», вышедшем в Лондоне в 1961 г., последняя часть раздела «Иттрий» посвящена не применению этого элемента, а лишь перспективам его применения. В «Курсе общей химии» Б. В. Некрасова (издание 1962 г.) говорится: «Практического применения отдельные элементы подгруппы скандия (а значит, и иттрий. — Ред.) и их производные еще не находят…» И это отражало истинное положение вещей.
Можно было считать иттрий перспективным. Залогом тому — его свойства: высокие температуры плавления и кипения — соответственно 1520 и 3030°C; упругость примерно такая же, как у алюминия и магния; прочность, сравнимая с прочностью титана. И плюс к этому относительная легкость (плотность иттрия 4,47 г/см 3) и малое эффективное сечение захвата тепловых нейтронов, т. е. способность почти не тормозить цепную реакцию, если иттрий применен в конструкции атомного реактора.
Но по каждой отдельно взятой характеристике иттрий уступал тому или иному металлу. Авиаконструкторы и проектировщики новых реакторов могут пока обойтись без него. Они, видимо, охотно применили бы иттрий, будь он более доступен, но каждый раз закладывали в свои проекты другие материалы — или с лучшими «природными данными», или менее дефицитные.
Читать дальшеИнтервал:
Закладка:










