Коллектив авторов - Популярная библиотека химических элементов. Книга первая. Водород — палладий
- Название:Популярная библиотека химических элементов. Книга первая. Водород — палладий
- Автор:
- Жанр:
- Издательство:Наука
- Год:1983
- Город:М.
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Коллектив авторов - Популярная библиотека химических элементов. Книга первая. Водород — палладий краткое содержание
содержит сведения обо всех элементах
известных человечеству. Сегодня их 107
причем некоторые получены искусственно.
Как неодинаковы свойства каждого из «кирпичей мироздания», так же неодинаковы их истории и судьбы. Одни элементы, такие
как медь, железо,
известны с доисторических времен. Возраст других измеряется только веками
несмотря на то, что ими, еще не открытыми, человечество пользовалось
незапамятные времена. Достаточно вспомнить о кислороде, открытом лить в
веке. Третьи открыты
лет назад
но лишь в наше время приобрели первостепенную важность. Это уран, алюминий, бор, литий, бериллий. У четвертых, таких, как, например, европий и скандий, рабочая биография только начинается. Пятые получены искусственно методами ядерно-физического синтеза
технеций, плутоний, менделевий
курчатовий… Словом
сколько элементов, столько индивидуальностей, столько историй
столько неповторимых сочетаний свойств.
В первую книгу вошли материалы о 46 первых, по порядку атомных номеров, элементах, во вторую
обо всех остальных.
Популярная библиотека химических элементов. Книга первая. Водород — палладий - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Теперь о других — более понятных и легче объяснимых свойствах элемента № 8.
Как и положено элементу, занимающему место в правом верхнем углу таблицы Менделеева, кислород обладает ярко выраженными окислительными свойствами. Наружная электронная оболочка атома кислорода состоит из шести электронов, и к предельно заполненной оболочке (условие максимальной химической устойчивости) атом кислорода может прийти двумя путями: или захватив два «посторонних» электрона, или отдав шесть. Первый путь, естественно, проще, он требует меньших затрат энергии. Поэтому в реакциях с подавляющим большинством атомов кислород выступает в роли окислителя. Если можно так выразиться, окислительнее кислорода только один элемент — фтор. Лишь в реакциях с фтором окислителем оказывается не элемент № 8, а его партнер.
Для развития активной реакции кислорода с большинством простых и сложных веществ нужно нагревание — чтобы преодолеть потенциальный барьер, препятствующий химическому процессу. Энергетическая «добавка» (энергия активации) в разных реакциях нужна разная. С фосфором кислород активно реагирует при нагревании последнего до 60, с серой — до 250, с водородом — больше 300, с углеродом (в виде графита) — при 700 — 800°С. Правда, есть вещества, например окись азота, соединения одновалентной меди и, к счастью, гемоглобин крови, способные реагировать с кислородом и при комнатной температуре. С помощью катализаторов, снижающих энергию активации, могут идти без подогрева и другие процессы, в частности соединение кислорода с водородом.
Обычно же эта реакция идет при повышенных температурах и протекает очень бурно — может даже перейти во взрыв. Такой процесс происходит но схеме разветвленной цепной реакции. (Теория ценных, реакций создана в результате работы многих ученых и в первую очередь — лауреата Нобелевской премии академика Н.Н. Семенова.) Ценные реакции начинаются с образования нестабильных активных частиц — свободных радикалов, «носителей» неспаренных электронов (па схеме они обозначены звездочками). Они-то и ведут реакцию «по цепочке»:
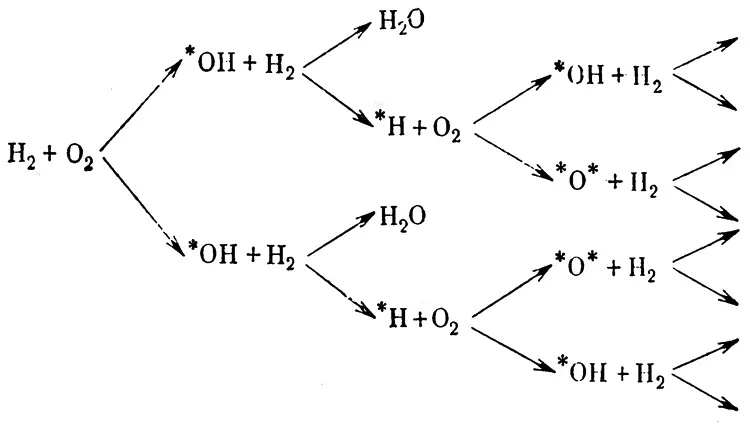
Высокая окислительная способность кислорода лежит в основе горения всех видов топлива, включая пороха, для горения которых не нужен кислород воздуха: в процессе горения таких веществ кислород выделяется из них самих.
Кислород — один из сильных окислителей. Об этом можно судить хотя бы потому, что баки с жидким кислородом — необходимая принадлежность большинства жидкостных ракетных двигателей.
Впрочем, далеко не всегда окислительные реакции с участием кислорода выглядят как стихия пламени или взрыва.
Процессы медленного окисления различных, веществ при обычной температуре имеют для жизни не меньшее значение, чем горение — для энергетики.
Медленное окисление, веществ пищи в пашем организме — «энергетическая база» жизни. (Заметим попутно, что наш организм не слишком экономно использует вдыхаемый кислород: в выдыхаемом воздухе кислорода примерно 16%.) Тепло преющего сена — результат медленного окисления органических веществ растительного происхождения. Медленное окисление навоза и перегноя согревает парники…
Но не всегда медленное окисление органических веществ безвредно и безопасно. Если тепло, выделяющееся в этом процессе, не отводится, может произойти самовоспламенение. Это известно издавна. В учебнике химии, выпущенном в России в 1812 г., рассказывалось о пожарах в Петербурге, вызванных этим явлением. «В 1770 г. сделался великий пожар в пеньковом магазине на острове Малыя Невы, где совсем не держали огня». Правда, в том же учебнике рассказывалось о случае самовоспламенения «одной ∙ старухи из Северной Америки» с примечанием, что «сие происходит преимущественно с людьми, невоздержанными в употреблении спиртных напитков»…
Памятуя о необходимости борьбы с пьянством силачи печати и науки, не стоило бы опровергать подобные заявления. Но, увы, факты — вещь упрямая: человеческий организм рассеивает тепло в пространстве, и даже самые прожженные пьяницы физически не могут самовоспламениться. Хорошо, что с научной точки зрения противоположный тезис — пьяного бог бережет — столь же несостоятелен.
Заканчивая главу о свойствах и особенностях кислорода, напомним — совсем коротко — о круговороте этого элемента в природе.
Если бы растения в процессе фотосинтеза не превращали воду и углекислый газ в органические соединения и этот процесс не сопровождался высвобождением связанного кислорода, то, исчерпав довольно быстро запасы атмосферного кислорода, весь животный мир, включая человечество, вскоре задохнулся бы. Но и растениям после этого пришлось бы несладко.
Дело в том, что растения, подобно животным, потребляют атмосферный кислород, правда, они делают это исключительно в темное время суток. На ночь, когда прекращаются процессы фотосинтеза, растения из производителей кислорода превращаются в его потребителей. Это явление наблюдал еще Шееле. А другой первооткрыватель кислорода Дж. Пристли еще до того, как кислород был открыт, выяснил, что зеленая ветка мяты, помещенная под стеклянный колпак с воздухом, в котором уже погасла свеча, возвращает этому воздуху способность поддерживать дыхание и горение.
Кислород и промышленность
Дуй к забою, дуй к забою,
Всюду, где народ,
На земле и под землею
Нужен кислород.
Эти строки вынесены в эпиграф отнюдь не за поэтические достоинства. Кислород действительно нужен «на земле и под землею» и вообще «всюду, где народ», например в космических кораблях. Первооткрыватель кислорода Дж. Пристли предугадал одно из важных применений элементного кислорода — в медицине. «Он может быть очень полезен при некоторых тяжелых болезнях легких, когда обычный воздух не может достаточно быстро удалять флогистонированные испорченные испарения».
Кислород применяется в лечебной практике не только при легочных и сердечных заболеваниях, когда затруднено дыхание. Подкожное введение кислорода оказалось эффективным средством лечения таких тяжелых заболеваний, как, например, гангрена, слоновость, трофические язвы.
Не менее важен элемент № 8 и для промышленности. Обогащение воздуха кислородом делает эффективнее, быстрее, экономичнее многие технологические процессы, в основе которых — окисление. А таких процессов — много. На них пока держится почти вся тепловая энергетика. Превращение чугуна в сталь тоже невозможно без кислорода. Именно кислород «изымает» из чугуна избыток углерода.
Читать дальшеИнтервал:
Закладка:










