Ларс Орстрём - Химия навсегда. О гороховом супе, опасности утреннего кофе и пробе мистера Марша
- Название:Химия навсегда. О гороховом супе, опасности утреннего кофе и пробе мистера Марша
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2021
- ISBN:978-5-389-19541-7
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ларс Орстрём - Химия навсегда. О гороховом супе, опасности утреннего кофе и пробе мистера Марша краткое содержание
Химия навсегда. О гороховом супе, опасности утреннего кофе и пробе мистера Марша - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Так что они попытались увильнуть (по крайней мере, так это показано в фильме) и даже объясняли жителям Хинкли, как полезен хром (и технически они были правы, ведь, как мы видели, в то время хром считался незаменимым для человеческого здоровья микроэлементом). Однако это не убедило судью даже несмотря на то, что PG&E нашла свидетелей-экспертов, давших показания в ее пользу (один из них позже был назначен администрацией Джорджа Буша-младшего на должность в экспертной комиссии Национального центра гигиены окружающей среды) [256] Hileman B. Balancing Panels, Charges Have Been Made that New Appointments to Committees Are Politically Motivated // Chemical & Engineering News, 10 (37–39). 10 March 2003.
.
Сложно предоставить бесспорные доказательства того, что болезни, развивающиеся в течение долгого времени, вызваны употреблением низких доз ядовитых веществ, но вряд ли это необходимо в данном случае. У нас перед глазами компания, которая пренебрегает инженерными нормами и тем самым загрязняет грунтовые воды молекулой, токсичные свойства которой хорошо известны. Концентрация этого вещества превышает установленный властями уровень [257] Hinkley Compressor Station Chromium Contamination Cleanup. Lahontan Regional Water Quality Control Board, California Environmental Protection Agency, 2013. URL: http://www.swrcb.ca.gov/rwqcb6/water_issues/projects/pge/index.shtml.
, и, конечно, к компании применяются карательные меры, независимо от того, в самом ли деле кто-то заболел в результате этих действий. Если вы превышаете скорость на дороге, попробуйте убедить дорожную полицию, что все в порядке, потому что вы пока что никого не убили. Была ли назначенная к выплате сумма 333 миллиона долларов адекватной – это уже совсем другой вопрос.
Однако давайте закончим эту главу на химической ноте и поговорим о степени окисления. В фильме то и дело упоминается «хром-шесть», то есть хром в степени окисления +6, которую часто записывают римскими цифрами – хром (VI). Иногда его также называют шестивалентным хромом: это означает, что ион металла может образовывать шесть связей с другими атомами, хотя на самом деле это архаичная и не слишком полезная концепция, так как маленький ион Cr 6+обычно связывается не более чем с четырьмя другими атомами, иначе ему становится тесновато.
Вернемся к предисловию этой книги: чтобы получить Cr (VI) из атома хрома, потребуется удалить все электроны с заполненных в последнюю очередь подуровней s и d с соответствующим типом орбиталей (или «загонов», если продолжать аллегорию с зебрами), так что в отношении электронного строения (количества электронов и их расположения) он становится совершенно таким же, как благородный газ аргон. Сходство с инертным аргоном придает неустойчивую стабильность этой высокой степени окисления по сравнению, например, с хромом (V) – похоже на монетку, балансирующую на ребре. Однако хром (VI) – крайне активный окислитель ввиду своей склонности заполнять некоторые из опустевших «загонов» электронами, и в присутствии частицы, легко отдающей электроны, эта монетка легко может упасть.
Вот почему питье воды с очень низкой концентрацией хромата считается менее рискованным, чем вдыхание частиц хромата (или даже содержащего их водяного пара). Хром (VI) следует восстановить (то есть уменьшить его степень окисления) внутри организма, прежде чем он успеет причинить вред.
Хром (VI) можно использовать для получения карбоновых кислот из спиртов, и сделать это можно гораздо быстрее и эффективнее, чем просто оставив открытой бутылку вина и позволив кислороду воздуха превратить его в уксус. Хром при этом вернется к более стабильной степени окисления, превратившись в хром (III). Для положительно заряженных ионов хрома и всех других переходных металлов s -орбитали станут менее привлекательными (их энергия выше), и только d -орбитали можно будет заполнить электронами. Вопрос состоит в том, как расставить электроны на этих доступных орбиталях.
Гораздо лучше иметь на орбитали электрон в полном одиночестве, чем два рядом, поскольку они отталкивают друг друга. Лучше также позволить им иметь одинаковый спин (или, как мы говорили ранее, одинаковый тип полосок на зебрах), поскольку, когда они достигают водопоя (ядра), они сближаются, а одинаковый спин автоматически заставляет их избегать друг друга. Итак, у нас будет по одному электрону с одинаковым спином на трех из пяти d -орбиталей, и это известно химикам как правило Хунда.
Почему же, когда Cr (VI) восстанавливается, мы обычно получаем степень окисления +3, а не +4 или +2? Потому что эти ионы привлекают к себе шесть других атомов, а Cr в степени окисления +2, +3 и +4 имеет больший размер, чем Cr (VI). Примером здесь может служить ион [Cr(H 2O) 6] 3+, изображенный на рисунке 42: по форме он более-менее похож на октаэдр.
При возникновении этих связей оказывается, что три из пяти различных d -орбиталей становятся более стабильными, потому что мы нередко позволяем электронным парам из соседних молекул или атомов перейти на две оставшиеся орбитали (и там у зебр будет серьезная конкуренция за траву). Самое выгодное расположение – это когда на каждой из трех более стабильных орбиталей находится по одному электрону, а две другие остаются пустыми – на рисунке 43 они показаны стрелками в ячейках. Подсчитав электроны, мы увидим, что именно это происходит с ионом хрома (III), и, следовательно, это приятная и стабильная степень окисления.
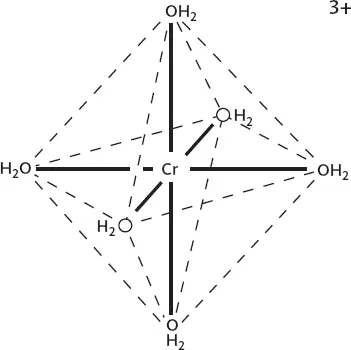
Рисунок 42.Ион [Cr(H 2O) 6] 3+: связи Cr – O выделены жирным, а октаэдрическая координационная геометрия молекулы изображена пунктирными линиями.
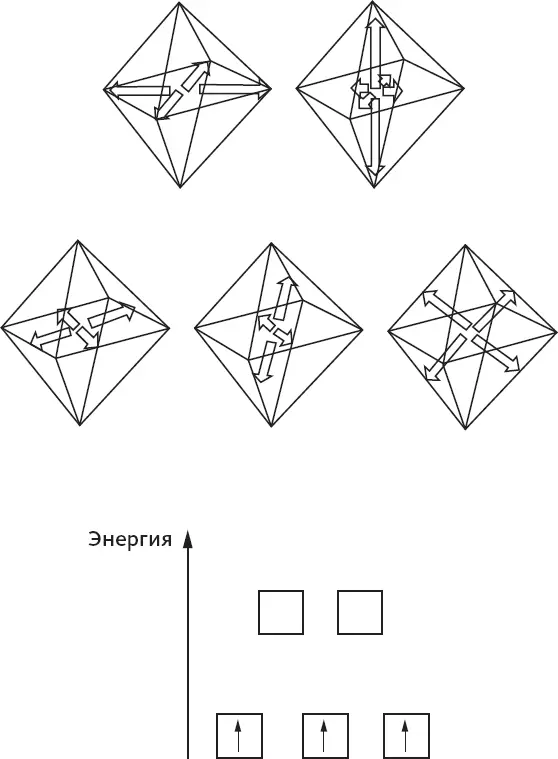
Рисунок 43.Основные направления ориентации пяти d -орбиталей, доступных для трех d -электронов, оставшихся в ионе [Cr(H 2O) 6] 3+. Две из них ориентированы по направлению к атомам кислорода в воде и предпочитают принимать электронную плотность у этих атомов. Это оставляет три другие орбитали трем электронам хрома, изображенным стрелками в ячейках на энергетической диаграмме орбиталей в нижней части рисунка.
После аварии, случившейся в Рино, Эрин Брокович и водитель второй машины могли быть подвергнуты быстрому анализу с участием хрома (VI). Иногда считается, что причина аварии – употребление алкоголя, а в то время самым простым тестом на трезвость была проверка дыхания водителя: яркий красно-оранжевый цвет дихромат-иона, Cr 2O 7 2–, еще одной формы Cr (VI), сменяется менее интенсивным зеленым цветом хрома (III), когда Cr (VI) вступает в реакцию с парами этанола в выдыхаемом воздухе, в результате чего образуется уксусная кислота и ионы Cr (III).
Читать дальшеИнтервал:
Закладка:










