Татьяна Лобаева - Основы биохимии. Учебно-тренировочные задания для студентов медицинских специальностей
- Название:Основы биохимии. Учебно-тренировочные задания для студентов медицинских специальностей
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2022
- ISBN:978-5-532-92483-3
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Татьяна Лобаева - Основы биохимии. Учебно-тренировочные задания для студентов медицинских специальностей краткое содержание
Основы биохимии. Учебно-тренировочные задания для студентов медицинских специальностей - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Ферменты
Ферменты(от лат. fermentum «закваска»), или энзиимы – обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции в биологических системах. Ферменты являются биокатализаторами, т. е. ускоряют химические реакции в клетке.
Проферментами зимогенами называютнеактивные предшественники ферментов, которые могут активироваться через избирательное расщепление белковой молекулы, реакции фосфорилирования или дефосфорилирования, диссоциации, а также агрегации протомеров и др.
Поскольку все ферменты являются белками, то обладают всеми физико-химическими свойствами белков. По структуре ферменты делятся на простые и сложные.
Простые ферментысостоят только из аминокислот – например, пепсин, трипсин, лизоцим. Сложные ферменты (холоферменты)имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор (коэнзим, кофермент).
С химической точки зрения, кофермент –это низкомолекулярное органическое соединение, являющееся составной частью сложного белка, обладающего каталитической активностью; большинство коферментов являются производными водорастворимых витаминов, а также нуклеозидов, пептидов и др.
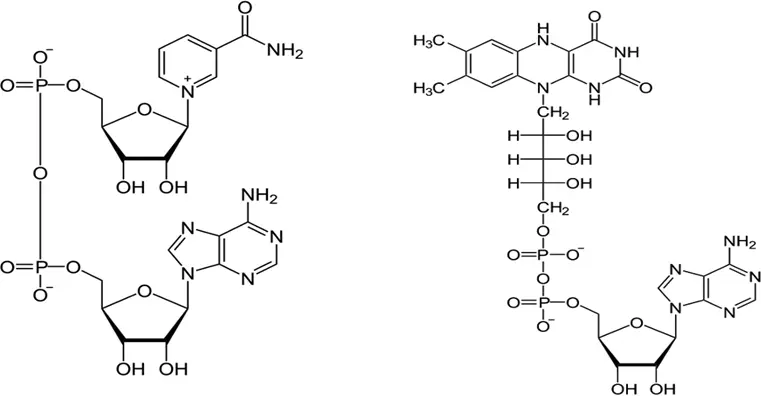
Рис. 3. Структура важнейших коферментов (НАД и ФАД)
Все ферменты, изученные к настоящему времени, включены в особый каталог (классификация ферментов – КФ) и имеют свой классификационный номер, в котором первая цифра указывает на принадлежность к одному из 7 классов ферментов:
1) оксидоредуктазы
2) трансферазы
3) гидролазы
4) лиазы
5) изомеразы
6) лигазы (синтетазы)
7) транслоказы
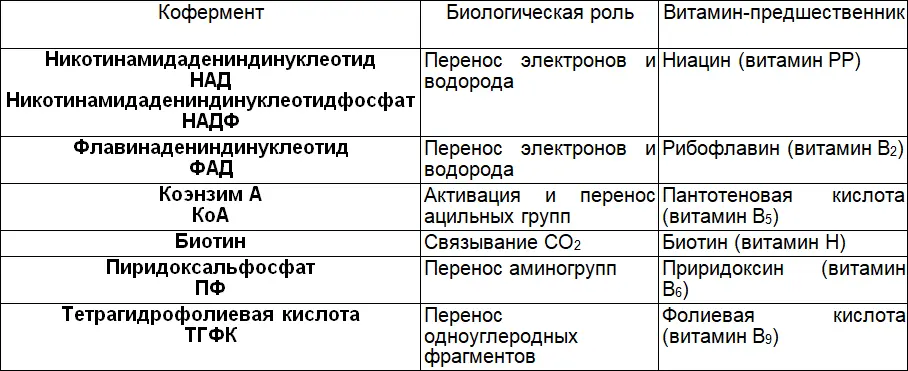
Таблица 7. Взаимосвязь витаминов и коферментов
Принципиальная структура фермента включает:
а) активный центр фермента– это уникальная комбинация аминокислотных остатков белковой молекулы, участвующих в присоединении и превращении субстрата, формируется на уровне третичной структуры. В активном центре выделяют субстратсвязывающий (якорный) участок и каталитический участок.
б) аллостерический центр– участок фермента, расположенный вне активного центра и присоединяющий низкомолекулярный аллостерический эффектор.
Примерами аллостерических эффекторовявляются низкомолекулярные лиганды, вызывающие изменение активности фермента вследствие их связывания в аллостерическом центре (НАД +, НАДН, АТФ, АДФ и др.).
Изучение ферментов (энзимов) выделено в отдельную науку – энзимологию. Все ферменты имеют белковую природу, чем объясняются их свойства (термолабильность, зависимость активности от рН среды, высокоспецифичное действие по отношению к реагирущим веществам – субстратам ферментативной реакции).

Рис. 4. Пример ферментативной реакции с участием оксидоредуктазы
Важнейшей характеристикой ферментативной реакции является константа Михаэлиса(К M) – это величина, характеризующая сродство фермента к субстрату; численно равна концентрации субстрата, при которой скорость реакции составляет половину максимальной скорости (V max).
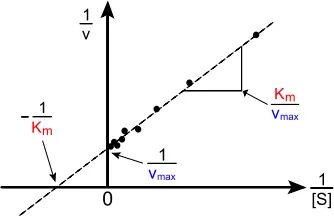
Рис. 5. Графическое изображение ферментативной реакции в обратных координатах
На активность фермента могут повлиять различные факторы. Существуют разные типы ингибирования ферментов.
Таблица 8. Типы ингибирования ферментов
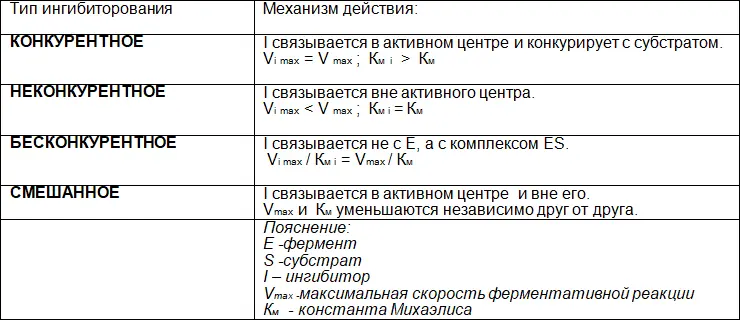
Конкурентное ингибирование– подавление скорости ферментативной реакции веществами, структурно сходными с субстратом. В этом случае, ингибитор связывается с активным центром фермента и вытесняется из него при повышении количества вступающего в реакцию субстрата; ингибирование характеризуется увеличением константы Михаэлиса (К M) без изменения максимальной скорости реакции (V max).
Другой вариант – неконкурентное ингибирование– подавление скорости ферментативной реакции веществами, не имеющими структурного сходства с субстратом и связывающимися не с активным центром, а в аллостерическом центре. В данном случае, блокируется каталитическое превращение субстрата, поэтому снижается максимальная скорость реакции, а величина константы Михаэлиса (К М) не меняется.
Активность ферментоввыражается в каталах (количество фермента, которое превращает 1 моль субстрата за 1 с), а также в международных единицах (Е) (количество фермента, превращающего 1 мкмоль субстрата за 1 мин).
Помимо отдельных ферментов известны и мультиферментные комплексы: пируватдегидрогеназный комплекс (пируватдегидрогеназа, ПДК), превращающий пируват в ацетил-SКоА, α-кетоглутаратдегидрогеназный комплекс (в цикле трикарбоновых кислот) превращающий α-кетоглутарат в сукцинил-SКоА, комплекс под названием "синтаза жирных кислот" (или пальмитатсинтаза), синтезирующий пальмитиновую кислоту.
Ферменты (энзимы) – биологические катализаторы белковой природы с регулируемой активностью; молекула фермента может быть простым или сложным белком. В сложном белке (холофермент) присутствует небелковый компонент – кофермент.
Энзимодиагностика – диагностика заболеваний, основанная на определении изменения активности ферментов (изоферментов) в биологических жидкостях и тканях; например, для панкреатита характерно повышение в плазме крови активности альфа-амилазы, для инфаркта миокарда – активности креатинкиназы, трансаминаз и др.
Энзимология – раздел биохимии, изучающий строение, свойства и механизм действия ферментов.
Энзимопатия – общее название патологических состояний, развивающихся вследствие отсутствия или изменения активности каких-либо ферментов. Наследственные энзимопатии связаны с генетически обусловленной недостаточностью одного или нескольких ферментов (фенилкетонурия, гистидинемия, гликогенозы, галактоземия, липидозы, мукополисахаридозы).
Читать дальшеИнтервал:
Закладка: