Айзек Азимов - Краткая история химии. Развитие идей и представлений в химии
- Название:Краткая история химии. Развитие идей и представлений в химии
- Автор:
- Жанр:
- Издательство:Мир
- Год:1983
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Айзек Азимов - Краткая история химии. Развитие идей и представлений в химии краткое содержание
Известный американский биохимик, популяризатор науки и писатель-фантаст А. Азимов знакомит читателя с предметом химии, историей возникновения и развития основных идей и представлений.
Краткая история химии. Развитие идей и представлений в химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Так, атом водорода в нормальных условиях соединяется только с одним атомом другого типа. То же самое можно сказать о натрии, хлоре, серебре, броме и калии. Валентность всех перечисленных элементов равна единице.
Атомы кислорода соединяются не менее чем с двумя различными атомами. Так же ведут себя кальций, сера, магний и барий. У этих элементов валентность два. У азота, фосфора, алюминия и золота валентность три. Железо может иметь валентность два или три. В принципе вопрос о валентности оказался не столь простым, каким представлялось вначале, но даже такой простейший вариант этой теории позволил сделать важные выводы.
Прежде всего с введением понятия «валентность» удалось уяснить различие между атомным весом (см. гл. 6) и эквивалентным весом элементов. Даже в середине XIX столетия многие химики еще путали эти два понятия.
При образовании хлорида водорода 1 атом водорода соединяется с 1 атомом хлора, а поскольку атом хлора в 35.5 раза тяжелее атома водорода, то, следовательно, водород и хлор соединяются в соотношении 1:35.5, т. е. атомный вес хлора равен 35.5. Однако такое соотношение элементов наблюдается не во всех соединениях. Например, каждый атом кислорода соединяется с 2 атомами водорода, так как валентность кислорода равна двум. Поскольку атомный вес кислорода равен 16, следовательно, 16 частей кислорода соединяются с 2 частями водорода. В результате эквивалентный вес кислорода, соединяющегося с 1 частью водорода, равен 16/2, или 8.
Аналогично атом азота (атомный вес 14, валентность 3) соединяется с 3 атомами водорода. Следовательно, эквивалентный вес азота равен 14/3, или примерно 4.7.
В общем эквивалентный вес атома равен его атомному весу, деленному на его валентность.
В то же время второй закон электролиза Фарадея (см. гл. 5) гласит, что вес металла, выделяемого в свободном состоянии при прохождении данного количества электричества, пропорционален эквивалентным весам этих металлов. Это означает, что при прохождении данного количества электричества вес выделяемого в свободном состоянии двухвалентного металла составляет только половину веса выделяемого в свободном состоянии одновалентного металла примерно равного атомного веса.
Это положение можно объяснить следующим образом: для перемещения одного одновалентного атома требуется один «атом электричества» (см. гл. 5), в то время как для перемещения одного двухвалентного атома требуются два «атома электричества». Однако природу зависимости между валентностью и «атомами электричества» удалось полностью выяснить лишь спустя еще полстолетия (см. гл. 5).
Структурные формулы [60] [60] Главные положения теории строения высказал А. М. Бутлеров в докладе «О химическом строении вещества», сделанном 9 сентября 1861 г. на съезде немецких естествоиспытателей и врачей. Бутлеровым были сформулированы правила, которыми можно было руководствоваться при определении строения органических соединений, а также было объяснено явление изомерии. А. Кекуле в 1865 г. распространил положения теории строения на ароматические соединения. Экспериментальное подтверждение теории химического строения Бутлеровым и его учениками имело огромное значение для ее утверждения.— Прим. ред.
Теория валентности сыграла важнейшую роль в развитии теории химии вообще и органической химии в особенности. Исходя из теории валентности, Кекуле предположил, что атом углерода четырехвалентен, и в 1858 г. попытался, опираясь на это предположение, представить строение наиболее простых органических молекул и радикалов [61] [61] Впервые А. М. Бутлеров изложил свои взгляды на теорию строения в лекциях, прочитанных им в Казанском университете в 1860 г., а в 1861 г. на Съезде немецких естествоиспытателей выступил с подробным докладом на эту тему. Самым главным вкладом Бутлерова, отличающим его труды от работ А. Кекуле и А. С. Купера, было последовательно проводимое положение о взаимосвязи между химическим строением и свойствами молекул. Это сделало понятие о химическом строении важнейшим теоретическим элементом химии. Подробнее см. упомянутые выше книги Г. В. Быкова (примечания 62 и 64).
. В том же 1858 г. шотландский химик Арчибальд Скотт Купер (1831—1892) предложил изображать силы, соединяющие атомы (или связи , как их принято называть), в виде черточек. После того как была «построена» первая органическая молекула, стало совершенно ясно, почему органические молекулы, как правило, значительно больше и сложнее, чем неорганические.
Согласно представлениям Кекуле, углеродные атомы могут соединяться друг с другом с помощью одной или нескольких из четырех своих валентных связей, образуя длинные цепи — прямые или разветвленные. По-видимому, никакие другие атомы не обладают этой замечательной способностью в той мере, в какой обладает ею углерод.
Итак, представив себе, что у каждого атома углерода четыре валентные связи, а у каждого атома водорода одна такая связь, можно изобразить три простейших углеводорода (соединения, молекулы которых образованы только атомами углерода и водорода), метан CH 4, этан C 2H 6и пропан C 3H 8, следующим образом:
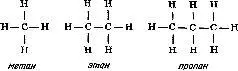
Увеличивая число атомов углерода, эту последовательность можно продолжить, причем практически бесконечно. Добавляя к углеводородной цепи кислород (две валентные связи) или азот (три валентные связи), можно представить структурные формулы молекул этилового спирта (C 2H 6O) и метиламина (CH 5N):
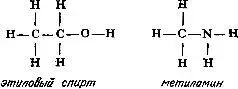
Допустив возможность наличия между соседними атомами двух связей ( двойная связь ) или трех связей ( тройная связь ), можно изобразить структурные формулы таких соединений, как этилен (C 2H 4), ацетилен (C 2H 2), метилцианид (C 2H 3N), ацетон (C 3H 6O) и уксусная кислота (C 2H 4O 2):

Полезность структурных формул была настолько очевидной, что многие химики-органики приняли их сразу. Они признали полностью устаревшими все попытки изображать органические молекулы как структуры, построенные из радикалов. В результате было признано необходимым, записывая формулу соединения, показывать его атомную структуру .
Русский химик Александр Михайлович Бутлеров (1823—1886) использовал эту новую систему структурных формул в разработанной им теории строения органических соединений [62] [62] См.: Быков Г. В. Александр Михайлович Бутлеров. Очерк жизни и деятельности.— М.: Изд-во АН СССР, 1961, 218 с; Быков Г. В. О приоритете А. М. Бутлерова в создании теории химического строения. В кн.: Материалы по истории отечественной химии.— М.: Изд-во АН СССР, 1953, с. 20—32.
. В 60-х годах прошлого столетия он показал, как с помощью структурных формул можно наглядно объяснить причины существования изомеров (см. гл. 5). Так, например, у этилового спирта и диметилового эфира одна и та же эмпирическая формула C 2H 6O, однако структурные формулы этих соединений значительно различаются:
Интервал:
Закладка: