М. Дроздова - Органическая химия
- Название:Органическая химия
- Автор:
- Жанр:
- Издательство:Конспекты, шпаргалки, учебники «ЭКСМО»b4455b31-6e46-102c-b0cc-edc40df1930e
- Год:2007
- Город:Москва
- ISBN:978-5-699-22063-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Дроздова - Органическая химия краткое содержание
Информативные ответы на все вопросы курса «Органическая химия» в соответствии с Государственным образовательным стандартом.
Органическая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Цетилпальмитат – основа спермацета, мирицил-пальмитат – содержится в пчелином воске. Номенклатура
Тривиальный, рациональнаый, МН (корень + окончание «-ол» + арабская цифра). Изомерия
Возможны варианты: изомерии цепи, положения группы – ОН, оптическая изомерия.
Спирты – слабые кислоты.
Спирты – слабые основания. Присоединяют Н+ лишь от сильных кислот, но они более сильные Nu.
(—I) эффект группы (-ОН) увеличивает подвижность Н у соседнего углеродного атома. Углерод приобретает d+ (электрофильный центр, SE) и становится центром нуклеофильной атаки (Nu). Связь С-О рвется более легко, чем Н-О, поэтому характерными для спиртов являются реакции SN. Они, как правило, идут в кислой среде, так как протонирование атома кислорода увеличивает d+ атома углерода и облегчает разрыв связи. К этому типу относятся реакции образования эфиров, галогенопроизводных.
Смещение электронной плотности от Н в радикале приводит к появлению СН-кислотного центра. В этом случае идут реакции окисления и элиминирования.
Физические свойства
Низшие спирты (С 1—С 12) – жидкости, высшие – твердые вещества.
Химические свойства
Кислотно-основные.
Спирты – слабые амфотерные соединения.
Алкоголяты легко гидролизуются, это доказывает, что спирты более слабые кислоты, чем вода:
R-ONa + НОН → R—OH + NaOH.
7. Химические свойства спиртов
Группа – ОН является «плохо уходя щей группой» (связь малополярна), поэтому большинство реакций проводят в кислой среде.
Механизм реакции:
СН 3 —СН 2 —ОН+ Н+ → СН 3 —СН 2 + Н 2 O.
карбокатион
Если реакция идет с галогеноводородами, то присоединяться будет галогенид-ион: СН 3 —СН 2 + Сl → СН 3 —СН 2 СI 1.
Анионы в таких реакциях выступают в качестве нуклеофилов (Nu) за счет «-» заряда или неподеленной электронной пары. Анионы являются более сильными основаниями и нуклеофильными реагентами, чем сами спирты. Поэтому на практике для получения простых и сложных эфиров используются алкоголяты, а не сами спирты. Если нуклеофилом является другая молекула спирта, то она присоединяется к карбокатиону:
СН 3 —СН 2 + R-0– Н → CH 3 —CH 2 —O-R.
простой эфир
Реакции Е (отщепления, или элиминирования). Эти реакции конкурируют с реакциями SN.
СН 3 —СН 2 —ОН + Н + → СН 3 —СН 2 —O – Н → СН 3 —СН 2 + Н 2 O.
Реакция протекает при повышенной температуре и катализаторе H 2 SO 4 .
При избытке H 2 SO 4 и более высокой температуре, чем в случае реакции образования простых эфиров, идет регенерация катализатора и образуется алкен:
СН 3 —СН 2 + HS 0 4 → СН 2 = СН 2 + H 2 SO 4 .
Легче идет реакция Е для третичных спиртов, труднее – для вторичных и первичных, т. к. в последних случаях образуются менее стабильные катионы. В данных реакциях выполняется правило А. М. Зайцева: «При дегидратации спиртов атом Н отщепляется от соседнего атома С с меньшим содержанием атомов Н».
В организме группа – ОН под действием фермента превращается в легкоуходящую путем образования эфиров с Н 3РО 4.
СН 3-СН 2-ОН + НО-РО 3Н 2 → СН 3-СН 2-ОРО 3Н 2.
Реакции окисления:
1. Первичные и вторичные спирты окисляются СиО, растворами KMnO 4К 2Сr 2O 7 при нагревании с образованием соответствующих карбонилсодержащих соединений.
СН 3 —СН 2 —СН 2 —ОН + О → СН 3 —СН 2 —НС = О + Н 2 О;
СН 3—HСOН—СН 3+ О → СН 3—СO—СН 3+ Н 2О.
2. Третичные спирты окисляются с трудом.
К реакциям окисления относятся и реакции дегидрирования.
СН 3 —СН 2 —ОН ־ СН 3 → НС = О + Н 2 .
IV. По радикалу (R) протекают реакции, характерные для соответствующих углеводородов (УВ).
СН 3-СН 2-ОН + 3Br 2→ СВr 3-СН 2-ОН + ЗНВг;
СН 2= СН-СН 2-ОН + Вr 2– → СН 2Вг-СНВг-СН 2ОН.
8. Многоатомные спирты
Для этих спиртов характерны все реакции одноатомных спиртов, однако имеется ряд особенностей.
За счет (-I) группы (-ОН) многоатомные спирты обладают более выраженными кислотными свойствами.
Они образуют алкоголяты не только со щелочными металлами, но и со щелочами:

Качественной реакцией на двухатомные и многоатомные спирты (диольный фрагмент) является реакция с Си(ОН)2 в щелочной среде, в результате которой образуется комплексное соединение гликолят меди в растворе, дающем синее окрашивание.
Реакции многоатомных спиртов могут протекать по одной или всем группам (-ОН). Они образуют алкоголяты, простые и сложные эфиры, дегидратируются, окисляются.
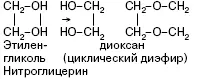
Нитроглицерин – бесцветная маслянистая жидкость. В виде разбавленных спиртовых растворов (1 %-ных) применяется при стенокардии, так как оказывает сосудорасширяющее действие. Нитроглицерин – сильное взрывчатое вещество, способное взрываться от удара или при нагревании. При этом в малом объеме, который занимает жидкое вещество, мгновенно образуется очень большой объем газов, что и вызывает сильную взрывную волну. Нитроглицерин входит в состав динамита, пороха.
Представители пентитов и гекситов – ксилит и сорбит – соответственно, пяти– и шестиатомные спирты с открытой цепью. Накопление (-ОН) – групп ведет к появлению сладкого вкуса. Ксилит и сорбит – заменители сахара для больных диабетом.
Глицерофосфаты – структурные фрагменты фос-фолипидов, применяются как общеукрепляющее средство. В результате действия Н 3 РО 4 на глицерин получают смесь глицерофосфатов. Глицерофосфаты
Глицерофосфат железа (III) применяется при анемии, астении, общем упадке сил. Детям по 0,3–0,5 г 2–3 раза в день, взрослым по 1 г 3–4 раза.
Глицерофосфат кальция – при переутомлении, рахите, упадке питания. Детям по 0,05—0,2 г на прием, взрослым по 0,2–0,5.
1. При действии на глицерин KHSО4 и при нагревании – образуется акролеин.
2. При окислении глицерина образуется ряд продуктов. При мягком окислении – глицериновый альдегид и дигидроксиацетон. При окислении в жестких условиях образуется 1,3-диоксоацетон.
9. Предельные (насыщенные) углеводороды
Простейший представитель подгруппы предельных углеводородов – метан (СН 4 ). И3 метана можно получить все другие предельные углеводороды, и в связи с этим все предельные углеводороды часто называются углеводородами ряда метана.
Для получения из метана других углеводородов вначале на метан нужно воздействовать хлором. При этом атом водорода в метане заменяется атомом хлора и получается хлористый метил.
Читать дальшеИнтервал:
Закладка:



![Бекки Рапинчук - Органическая уборка для безопасности всей семьи. Дом без химии [litres]](/books/1067073/bekki-rapinchuk-organicheskaya-uborka-dlya-bezopasnost.webp)






