Илья Леенсон - Удивительная химия
- Название:Удивительная химия
- Автор:
- Жанр:
- Издательство:М. : ЭНАС, 2009. - 176 с
- Год:2009
- ISBN:978-5-93196-925-1
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Илья Леенсон - Удивительная химия краткое содержание
В увлекательной форме изложены оставшиеся за рамками школьных учебников сведения о химической науке, величайших открытиях ученых-химиков, загадочных фактах и уникальных химических экспериментах.
Для школьников, студентов и учителей, а также для всех, кто желает открыть для себя незнакомую, полную тайн и парадоксов химию.
Удивительная химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Но есть ли у нас гарантия, что молекулы машинного масла растеклись по воде в один слой? Ведь только в этом случае толщина пленки будет соответствовать размеру молекул.
Такой гарантии у нас нет, и вот почему. Молекулы, входящие в состав машинного масла, называют гидрофобными (в переводе с греческого «гидрофобные» — «боящиеся воды»). Они довольно хорошо «сцепляются» между собой, очень неохотно — с молекулами воды. Если вещество, подобное машинному маслу, налить на поверхность воды, оно образует на ней довольно толстую (по молекулярным меркам) пленку, состоящую из сотен и даже тысяч молекулярных слоев. Помимо того, что подобные расчеты любопытны и сами по себе, они имеют большое практическое значение. Например, по сей день не удается избежать аварий огромных танкеров, перевозящих нефть за тысячи километров от места ее добычи. В результате такой аварии в море может вылиться огромное количество нефти, что губительно скажется на живых организмах. Нефть более вязкая по сравнению с машинным маслом, поэтому ее пленка на водной поверхности может оказаться несколько толще. Так, в одной из аварий вылилось 120 000 тонн нефти, которая покрыла площадь 500 км 2. Как показывает несложный расчет, средняя толщина такой пленки равна 200 мкм. Толщина пленки зависит как от сорта нефти, так и от температуры воды: в холодных морях, где нефть делается более густой, пленка толще, в теплых морях, где нефть становится менее вязкой, — тоньше. Но в любом случае авария большого танкера, когда в море попадают десятки тысяч тонн нефти, — это катастрофа. Ведь если вся пролитая нефть растечется тонким слоем, то образуется пятно огромной площади, и ликвидировать такую пленку чрезвычайно трудно.
А можно ли заставить вещество растекаться по воде так, чтобы образовался всего один слой молекул (такая пленка называется мономолекулярной)? Оказывается, это возможно, только вместо машинного масла или нефти надо взять другое вещество. Молекулы такого вещества должны на одном конце иметь так называемую гидрофильную (т. е. «водолюбивую») группу атомов, а на другом конце — гидрофобную. Что будет, если вещество, состоящее из таких молекул, поместить на поверхность воды? Гидрофильная часть молекул, стремясь раствориться в воде, будет тянуть молекулу в воду, тогда как гидрофобная часть, которая воды «боится», будет упорно избегать контакта с водой. В результате такого взаимного «непонимания» молекулы (если их слегка «поджать» сбоку с помощью планочки) выстроятся на поверхности воды так, как показано на рис. 3.1: их гидрофильные концы утоплены в воду, а гидрофобные торчат наружу.
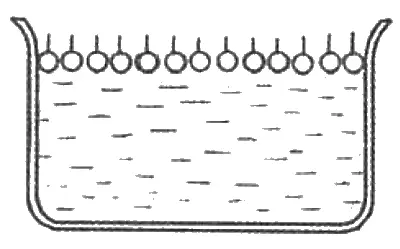
Вещества, которые ведут себя таким образом, называют поверхностно-активными. К ним относятся, например, мыло и другие моющие средства; олеиновая кислота, входящая в состав подсолнечного масла; пальмитиновый спирт, который входит в состав пальмового масла и китового жира. Растекание таких веществ по поверхности воды дает значительно более тонкие пленки, чем машинное масло. Это явление было известно давно, подобные опыты проводили еще в XVIII веке. Но только в конце XIX — начале XX столетия в результате экспериментов, проведенных английским физиком Джоном Уильямом Рэлеем (1842–1919), немецким физиком Вильгельмом Конрадом Рентгеном (1845–1923) и рядом других ученых, было показано, что толщина пленки может достигать таких малых размеров, которые сопоставимы с размерами отдельных молекул.
В одном из таких опытов английский химик Нейл Кенсингтон Адам (1891–1973) наблюдал в 1922 году образование на поверхности воды пленок пальмитинового спирта. Оказалось, что очень маленькое количество пальмитинового спирта — всего 0,052 мг дает пленку площадью 193 см 2. Так как плотность спирта равна 0,818 г/см 3, то объем пленки составляет 6,36 x 10 -5см 3, при толщине всего лишь 6,36 x 10 -5см 3/ 193 см 2= 3,3 x 10 -7см, или 3,3 нм. Значит, молекула пальмитинового спирта по длине примерно в 10 раз больше молекул кислорода.
Размеры порядка 1 нм имеют большинство молекул и ионов знакомых нам веществ. Так, диаметр молекул водорода равен примерно 0,2 нм, иода — 0,5 нм, этилового спирта — 0,4 нм; радиус ионов алюминия — 0,06 нм, натрия — 0,10 нм, калия — 0,13 нм, хлора — 0,18 нм, иода — 0,22 нм. Но есть среди молекул и гиганты, размеры которых, по молекулярным меркам, поистине астрономические. Так, в ядрах клеток высших животных и растений находятся молекулы наследственности — дезоксирибонуклеиновые кислоты (ДНК). Их длина может превышать 2 000 000 нм, т. е. 2 мм!
В заключение этого раздела — небольшой рассказ о том, какой остроумный (хотя и не самый точный) метод использовал в 1908 году французский ученый Жан Перрен, чтобы «взвесить» молекулы. Как известно, плотность воздуха уменьшается с высотой. Еще в начале XIX века французский ученый Пьер Лаплас вывел формулу, позволяющую рассчитать давление на разных высотах. В соответствии с этой формулой атмосферное давление падает вдвое при подъеме на каждые 6 км. Это значение зависит, конечно, от силы земного притяжения, а также от массы молекул воздуха. Если бы воздух состоял не из азота и кислорода, а из очень легких молекул водорода (они в 16 раз легче молекул кислорода), то падение атмосферного давления вдвое наблюдалось бы на высоте не 6 км, а примерно в 16 раз больше, т. е. около 100 км. И наоборот, если бы молекулы были очень тяжелые, атмосфера была бы «прижата» к поверхности Земли и давление быстро падало бы с высотой.
Рассуждая таким образом, Перрен решил вместо молекул использовать крошечные шарики краски гуммигута, взвешенные в воде. Он постарался приготовить взвесь (эмульсию) с одинаковыми по размеру шариками — около 1 мкм в диаметре. Затем он поместил капельку эмульсии под микроскоп и, перемещая винт микроскопа по вертикали, считал число шариков гуммигута на разных высотах. Оказалось, что формула Лапласа вполне применима и к эмульсиям: при подъеме на каждые 6 мкм число шариков в поле зрения уменьшалось в два раза. Поскольку 6 км ровно в миллиард раз больше 6 мкм, Перрен сделал вывод, что во столько же раз молекулы кислорода и азота легче шариков гуммигута (а их массу уже можно определить экспериментально).
ХИМИКИ АНАЛИЗИРУЮТ
Чтобы повторить в лаборатории то, что давно «изобрела» природа, а потом воспроизвести этот синтез на химических предприятиях в промышленном масштабе, необходимо прежде всего знать, из каких элементов построены нужные нам вещества. Этим занимается качественный анализ. Такой анализ всегда считался одной из важнейших задач химии. Он начал интенсивно развиваться в конце XVIП века. С помощью методов качественного анализа французский химик Мишель Эжен Шеврёль (1786–1889) в начале XIX века выяснил, например, из каких элементов состоит дорогой синий краситель индиго, свиной жир и даже… кости динозавра.
Читать дальшеИнтервал:
Закладка:










