Илья Леенсон - Удивительная химия
- Название:Удивительная химия
- Автор:
- Жанр:
- Издательство:М. : ЭНАС, 2009. - 176 с
- Год:2009
- ISBN:978-5-93196-925-1
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Илья Леенсон - Удивительная химия краткое содержание
В увлекательной форме изложены оставшиеся за рамками школьных учебников сведения о химической науке, величайших открытиях ученых-химиков, загадочных фактах и уникальных химических экспериментах.
Для школьников, студентов и учителей, а также для всех, кто желает открыть для себя незнакомую, полную тайн и парадоксов химию.
Удивительная химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Наконец, последний класс люминофоров — радиолюминофоры, свечение которых возбуждается излучением естественных или искусственных радиоактивных препаратов. Такие люминофоры могут светиться годами. Радиолюминофоры сыграли в свое время огромную роль в изучении явлений радиоактивности: до изобретения электроизмерительных приборов (ионизационной камеры, счетчика Гейгера-Мюллера) ими покрывали небольшие пластинки-экраны и затем в полной темноте, иногда ночи напролет, подсчитывали число вспышек (сцинтилляций), чтобы определить интенсивность излучения от разных источников (более подробно об этом будет рассказано в следующей главе). Для покрытия экранов использовали ярко светящийся, но дорогой препарат платины. Под действием радиации в нем возбуждается яркая желто-зеленая люминесценция. В настоящее время используют значительно более дешевые люминофоры, например, активированный медью сульфид цинка. У кого-то, возможно, еще остались часы, в которых стрелки и цифры покрыты таким светящимся составом постоянного действия — в нем содержится в малых количествах радиоактивное вещество; из-за опасений нанести вред здоровью и тех, кто такие часы бы носил, и в еще большей мере тех, кто такие часы бы изготовлял, — их сейчас не выпускают.
Совершенно особую группу светящихся веществ составляют соединения, испускающие свет за счет энергии химических реакций. Это явление называется хемилюминесценцией. Общеизвестно свечение гнилушек, светляков, некоторых морских организмов. Еще в древние времена моряки наблюдали свечение моря. Карфагенский флотоводец Ганно описал море, «горевшее ярким пламенем». А вот воспоминания Чарльза Дарвина: «Как-то в очень темную ночь вся поверхность моря светилась слабым светом. Корабль гнал перед собой две волны, точно из жидкого фосфора, а в кильватере тянулся молочный свет. Насколько хватало глаз, светился гребень каждой волны, а небосклон у горизонта, отражавший сверкание этих синеватых огней, был не так темен, как небо над головой». Это светились простейшие одноклеточные организмы. Светиться способны и многие морские животные, обитающие как на поверхности моря, так и на глубине.
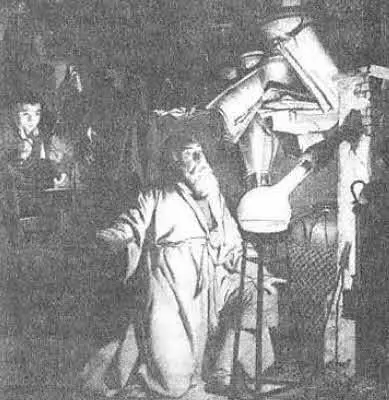
Испускают свет не только морские организмы. Светятся гнилушки и пни в лесу, яркий мерцающий свет испускают самцы светляков. Это примеры биолюминесценции — свечения в живых организмах. Причина всех описанных явлений — химические реакции, идущие с выделением энергии. Обычно в ходе химических реакций энергия выделяется в виде тепла, но в редких случаях часть химической энергии переходит в световую. В живых организмах реакции, в том числе и с выделением света, регулируются особыми молекулами — ферментами. Давно известны и неферментативные химические реакции, в ходе которых наблюдается «холодное свечение». Еще в 1669 году немецкий алхимик из Гамбурга Хенниг Бранд (1630 — после 1710) случайно открыл белый фосфор по его свечению в темноте (рис. 6.3). Впоследствии химики выяснили, что белый фосфор легко испаряется и светятся его пары, когда они реагируют с кислородом воздуха. Это свечение подробно исследовали в 1920-х годах в Ленинградском физико-техническом институте в лаборатории Николая Николаевича Семенова (1896–1986). В результате был открыт совершенно новый класс химических реакций; за это открытие Н. Н. Семенов совместно с английским химиком Сирилом Норманом Хиншелвудом (1897–1967) был удостоен Нобелевской премии по химии.
Свечение паров фосфора, хотя и привело к важному научному открытию, не имеет практического значения. Однако химики обнаружили, что при окислении некоторых органических веществ, например, перекисью водорода, наблюдается настолько яркая хемилюминесценция, что ее можно видеть даже при дневном освещении. Это явление уже используется для производства игрушек и украшений. Их делают в виде прозрачных пластмассовых трубочек, внутри которых находится раствор органического вещества, обладающий способностью светиться при окислении, а также стеклянная ампула с перекисью водорода. Непосредственно перед «применением» продавец (или покупатель) надламывает находящуюся в пластмассовой трубочке хрупкую ампулу, что и «запускает» реакцию. Цвет свечения может быть разным — оранжевым, голубым, зеленым и т. д. — в зависимости от находящегося в растворе красителя. Чем быстрее идет реакция окисления, тем ярче свечение. Но когда реакция идет быстро, она быстро и прекращается, а с ней прекращается и свечение. Если же реакция идет медленно, то длится она, конечно, дольше, но свечение получается менее ярким (так, если смесь держать в морозильнике, то свечение заметно даже через полгода после «запуска» реакции). Обычно выбирают «золотую середину», что в данном случае означает довольно яркое (можно читать в темноте) свечение, которое затухает в течение примерно 12 часов — для карнавала или дискотеки этого вполне достаточно. Туристы, побывавшие в итальянском парке «Гардаленд» (аналог американского «Диснейленда»), рассказывают, что видели одновременно сотни светящихся украшений, сделанных в виде цветков, бабочек, жуков и других насекомых, в которых щеголяли посетители (в основном, дети) после наступления темноты. Эффект усиливался множеством усиков-световодов, передающих свет на 10–20 см от его источника — ампулы с реагентами. Зрелище впечатляющее! К сожалению, после прекращения химической реакции свечение затухает и возобновить его уже невозможно.
ХИМИКИ ИЗУЧАЮТ РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ
Масса — не единственное свойство, по которому можно отличить изотопы одного и того же химического элемента, этих химических «близнецов». Исследования показали, что изотопы всех элементов по своему поведению можно разделить на две группы. Одни ведут себя смирно: какими они появились на свет, такими и остались. Причем появиться они могли и много миллиардов лет назад — когда возникла Вселенная, и совсем недавно. Поведение же других изотопов химических элементов прямо противоположное: они непрерывно «меняют лицо», превращаясь в изотопы других элементов. Такие превращения принято называть радиоактивным распадом. Почему распад — понятно: «смена лица» фактически приводит к уничтожению атомов данного элемента, к их распаду. А радиоактивными эти превращения названы потому, что они сопровождаются испусканием особых лучей. Что же это за лучи?
Читать дальшеИнтервал:
Закладка:










