Виктор Михайлов - Физические основы получения атомной энергии
- Название:Физические основы получения атомной энергии
- Автор:
- Жанр:
- Издательство:Военное Издательство Министерства обороны Союза ССР
- Год:1958
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Виктор Михайлов - Физические основы получения атомной энергии краткое содержание
2 0
/i/53/718753/Grinya2003.png
0
/i/53/718753/CoolReader.png
Физические основы получения атомной энергии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Обстреливая альфа-частицами атомы нерадиоактивных элементов, супруги Фредерик и Ирен Жолио-Кюри открыли в 1934 г. искусственную радиоактивность. Жолио-Кюри установили, что в результате проникновения альфа-частиц в ядра алюминия, бора, магния и других веществ образуются радиоактивные ядра, отсутствующие в природе.
«Ядерная» артиллерия сыграла решающую роль в изучении состава атомного ядра.
Обстреливая атомы различных элементов быстрыми частицами, удалось установить, что в ядрах всех атомов имеются протоны, то есть ядра атомов водорода с массой, приблизительно равной атомной единице, и с единичным положительным зарядом. Точнее, масса протона по современным данным равна 1,00759 а.е.м.
Первоначально предполагалось, что, помимо протонов, в состав ядра входят еще и электроны и что ядра всех атомов построены из протонов и электронов. Однако позже выяснилось, что такое предположение неправильно и противоречит ряду опытных фактов. Современное учение о строении атомного ядра зародилось в 1932 г. Непосредственным толчком к его возникновению послужило открытие в 1932 г. английским физиком Чадвиком новой, неизвестной до того времени «элементарной» частица — нейтрона.
Нейтрон — нейтральная, то есть не имеющая электрического заряда, частица с массой, равной приблизительно массе протона. Точное значение массы нейтрона равно 1,00898 а.е.м. , что превосходит массу протона на 2,5 массы электрона.
Благодаря отсутствию электрического заряда нейтрон не производит ионизации атомов, мимо которых он пролетает, и поэтому может свободно проникать через толстые слои вещества. Не имея заряда и не испытывая вследствие этого действия сил электрического отталкивания со стороны положительно заряженных ядер, нейтрон способен проникать в глубь самых тяжелых ядер и поэтому является наилучшей частицей для их обстрела и последующего расщепления.
В том же 1932 г., когда был открыт нейтрон, советский физик Д. Д. Иваненко первым выдвинул идею о том, что ядра всех атомов состоят из протонов и нейтронов. Протонно-нейтронная теория строения ядра, развитая в работах советских и зарубежных физиков, является в настоящее время общепризнанной.
Число протонов в ядре атома какого-либо химического элемента равно числу «элементарных» зарядов ядра, то есть порядковому номеру этого элемента Z в периодической системе Менделеева (атомному номеру).
Общее же число протонов и нейтронов в ядре атома равняется его атомному весу А , округленному до целых единиц, то есть массовому числу. Отсюда нетрудно сообразить, что разность между массовым числом атома А и его атомным номером Z дает число нейтронов в ядре N = А - Z. Протоны и нейтроны, составляющие ядро, обычно называют нуклонами.
Самое простое ядро — ядро атома легкого водорода (протия) — состоит из одного протона. Все остальные ядра, помимо протонов, имеют и нейтроны. В ядре атома гелия, массовое число которого равно 4, имеется два протона и два нейтрона. В ядре наиболее распространенных атомов кислорода содержится 8 протонов и 8 нейтронов (массовое число 16).
В ядрах легких элементов число протонов обычно равно числу нейтронов. Ядра средних и тяжелых элементов имеют избыток нейтронов. Наиболее тяжелое из существующих в природе ядер — ядро урана с массовым числом 238 содержит 92 протона и 146 нейтронов. Состав атомных ядер некоторых элементов показан схематически, без соблюдения масштаба, на рис. 17.
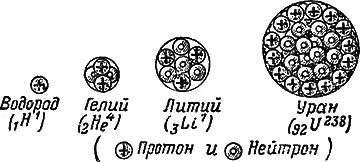
Ядра атомов различных химических элементов обозначаются значками, присвоенными этим элементам в химии. Справа сверху от этого знака ставится общее число нуклонов в ядре, то есть массовое число, а снизу слева — число протонов, то есть атомный номер. Соответственно этому ядро обычного водорода обозначается 1H 1, гелия — 2He 4, кислорода — 8O 16, урана 92U 238и т. д.
Число протонов в ядре атома какого-либо элемента полностью определяет химические свойства этого элемента, его химическую принадлежность. До тех пор пока число протонов в ядре остается неизменным, атом данного химического элемента остается атомом этого элемента. При нормальном состоянии атома число электронов в его оболочке, окружающей ядро, равно числу протонов в ядре. Ионизация атома, то есть удаление из его оболочки одного или нескольких электронов, не затрагивает ядра: ядро остается при этом неизменным.
Нейтрон может превратиться в протон и наоборот. Подобные превращения бывают в распадающихся ядрах радиоактивных элементов, испускающих бета-частицы.
Превращение одного из нейтронов ядра в протон сопровождается рождением электрона и маленькой нейтральной частички — нейтрино, которые тотчас же и выбрасываются из ядра с огромной скоростью. Этот новорожденный электрон и представляет собой известную нам бета-частицу. Образование бета-частицы и нейтрино происходит за счет той избыточной массы, которой обладает нейтрон по сравнению с протоном. Превращение нейтрона в протон наблюдается в тех ядрах, которые имеют избыток нейтронов, то есть имеют их больше, чем это требуется для устойчивого существования ядра. Подобное же самопроизвольное превращение испытывает и свободный нейтрон, находящийся вне ядра.
Превращение свободного протона в нейтрон обычно в природе не наблюдается, поскольку масса протона меньше массы нейтрона, и не обеспечивает такого превращения. Но, находясь внутри ядра, протон может превратиться в нейтрон. Такое превращение наблюдается в ядрах некоторых искусственно радиоактивных веществ, получаемых путем бомбардировки разных нерадиоактивных материалов быстрыми частицами. В ядрах атомов этих веществ слишком мало нейтронов, а протонов имеется в избытке. В этом случае один из протонов ядра, получивший добавочную массу и энергию за счет бомбардирующих частиц, может превратиться в нейтрон, испуская положительный электрон ( позитрон) и нейтрино.
Возможен и второй путь превращения протона в нейтрон. Протон может захватить один из электронов атома, вращающихся вокруг ядра, и стать в результате этого нейтроном. Чаще всего происходит захват электрона из ближайшего к ядру слоя K электронной оболочки. Вследствие этого такой процесс получил название Л-захвата. Представление о том, что электроны и протоны рождаются в ядре в результате превращения протонов и нейтронов друг в друга, было выдвинуто и обосновано Д. Д. Иваненко.
2. Атомы-изотопыЯдра атомов какого-либо элемента при строго определенном числе протонов, равном атомному номеру элемента, могут иметь различное число нейтронов и, следовательно, различный вес. Атомы данного элемента, имеющие разный вес вследствие различия в числе нейтронов, называются изотопамиэтого элемента. Само слово «изотоп» происходит от греческого: «изос»— равный и «топос»— место. Следовательно, буквально изотопы — это атомы, занимающие в периодической системе Менделеева одинаковое место.
Читать дальшеИнтервал:
Закладка:










