Стивен Хокинг - Вселенная Стивена Хокинга
- Название:Вселенная Стивена Хокинга
- Автор:
- Жанр:
- Издательство:Литагент АСТ
- Год:2018
- Город:Москва
- ISBN:978-5-17-102285-3
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Стивен Хокинг - Вселенная Стивена Хокинга краткое содержание
Вселенная Стивена Хокинга - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
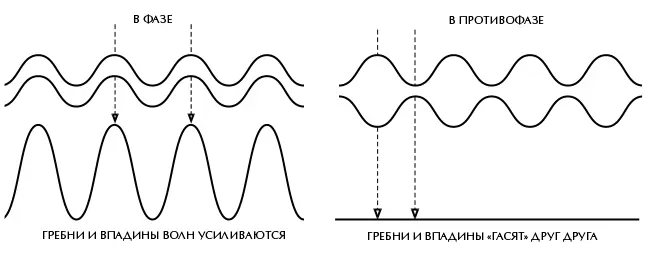
Рис. 4.1
Интерферировать могут и частицы – из-за обусловленного квантовой механикой волнового дуализма. Одним из наиболее известных примеров является так называемый двухщелевой эксперимент (рис. 4.2). Представьте себе перегородку – тонкую стенку – с двумя узкими параллельными щелями. С одной стороны от перегородки разместим источник света определенного цвета (то есть с определенной длиной волны). Большая часть света попадет в перегородку, но небольшое его количество пройдет через щели. Теперь представьте, что вы установили с другой стороны от перегородки экран. На любую точку этого экрана приходит свет из обеих щелей. Но в общем случае пути, которые свет проходит от источника до экрана через щели, отличаются друг от друга. Это означает, что волны, приходящие от двух щелей, окажутся не в фазе, когда они достигнут экрана. В некоторых местах впадины одной волны наложатся на гребни другой, и волны взаимно погасят друг друга, а в других местах гребни двух волн наложатся друг на друга, то же произойдет со впадинами, в результате чего волны усилят друг друга. Таким образом возникает характерный узор чередующихся светлых и темных полос.
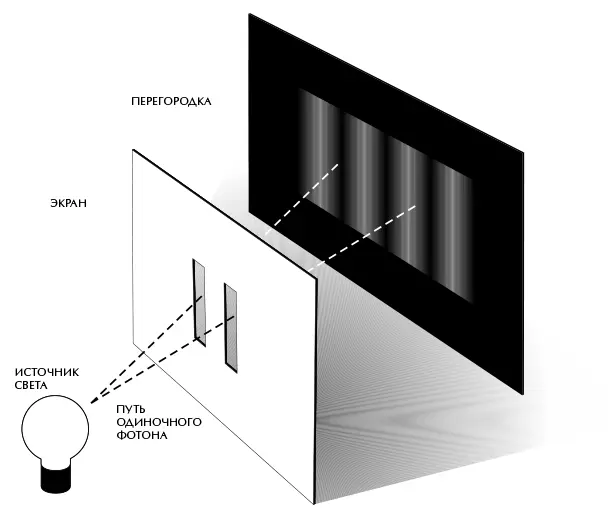
Рис. 4.2
Удивительно, что точно такая же картина из полос наблюдается, если заменить источник света источником потока частиц, например электронов, движущихся с определенной скоростью. (Это означает, что соответствующие им волны имеют определенную длину.) Это особенно неожиданно, если учесть, что если в перегородке только одна щель, никаких полос не наблюдается – электроны равномерно распределяются по экрану. Логично предположить, что если сделать в перегородке вторую щель, то результатом будет простое увеличение числа электронов, попадающих в каждую точку на экране. Но из-за интерференции число электронов в некоторых местах, наоборот, уменьшается. Если отправлять электроны через щели по одному, то естественно было бы ожидать, что каждый электрон пройдет через одну из щелей и распределение электронов за перегородкой будет таким же, как если бы мы имели дело с прохождением электрона через единственную щель – то есть равномерное распределение на экране. Но в реальности интерференционная картина наблюдается, даже если электроны выпускать по одному. Таким образом, каждый электрон должен проходить одновременно через обе щели!
Явление интерференции между частицами играет ключевую роль в нашем понимании строения атомов – основных структурных элементов, лежащих в основе химии и биологии, и тех самых «кирпичиков», из которых состоим мы и всё вокруг нас. В начале ХХ века считалось, что атомы похожи на Солнечную систему, – в них электроны (отрицательно заряженные частицы) обращаются вокруг положительно заряженного ядра в центре. Считалось, что взаимное притяжение положительных и отрицательных электрических зарядов удерживает электроны на их орбитах, подобно тому как гравитационное притяжение между Солнцем и планетами удерживает планеты на их орбитах. Проблема состояла в том, что согласно доквантовым законам механики и законам электрического взаимодействия электроны должны были потерять свою энергию и, двигаясь по спирали, упасть на ядро. Это означало, что атомы, да и все вещество, должны были быстро сколлапсировать до сверхплотного состояния. В 1913 году датский ученый Нильс Бор предложил частичное решение этой проблемы. Он предположил, что орбиты электронов не могут находиться на произвольном расстоянии от центрального ядра, а только на вполне определенном. Если же допустить, что на каждом из этих расстояний могут находиться орбиты не более двух электронов, то это решает проблему «схлопывания» атома: заполнив орбиты с наименьшими энергиями и расстояниями от ядра, электроны просто не могут подойти к ядру ближе.
Эта модель неплохо объясняла строение простейшего атома – атома водорода, в котором вокруг ядра обращается один-единственный электрон. Но было непонятно, как эту модель распространить на более сложные атомы. К тому же идея об ограниченном наборе допустимых орбит казалась очень уж произвольной. Новая теория квантовой механики справилась с этой трудностью. Эта теория показала, что обращающийся вокруг ядра электрон можно рассматривать как волну, длина которой зависит от его скорости. Длины некоторых орбит равны целому (а не дробному) числу длин волн электрона. У этих орбит после каждого оборота гребни оказываются на том же месте, и такие волны усиливаются. Эти орбиты соответствуют разрешенным орбитам Бора. А вот у орбит, длина которых не равна целому числу длин волн, каждый горб на каком-то обороте электрона окажется погашенным впадиной. Такие орбиты не являются допустимыми.
Американский физик Ричард Фейнман предложил наглядный способ представить корпускулярно-волновой дуализм путем так называемого суммирования по траекториям. Этот подход предполагает, что у частицы не одна-единственная траектория в пространстве-времени, как в случае классической, неквантовой теории. Вместо этого считается, что частица движется из точки А в точку В всеми возможными путями. Каждому пути из А в В Фейнман поставил в соответствие пару чисел – амплитуду, то есть размах волны, и фазу – положение волны в цикле (гребень или впадина). Вероятность для частицы попасть из А в В рассчитывается суммированием волн, соответствующих всем траекториям, ведущим из А в В . В общем случае фазы – то есть положения гребней и впадин волн – близких соседних траекторий сильно различаются. Это значит, что связанные с этими траекториями волны гасят друг друга. Но у некоторых наборов соседних траекторий различия фаз оказываются малыми, и соответствующие этим траекториям волны не гасят друг друга. Такие траектории соответствуют боровским допустимым орбитам.
На основе этих представлений, облеченных в конкретную математическую форму, оказалось довольно нетрудно рассчитать допустимые орбиты для более сложных атомов и даже молекул, состоящих из нескольких атомов, связанных электронами, которые обращаются сразу вокруг нескольких ядер. Поскольку строение молекул и их реакции лежат в основе всей химии и биологии, квантовая механика в принципе позволяет предсказать все происходящее вокруг нас в пределах, установленных принципом неопределенности. (Но на практике расчеты для систем с несколькими электронами оказываются настолько сложными, что не могут быть выполнены [аналитически].)
Читать дальшеИнтервал:
Закладка:

![Стивен Хокинг - Теория всего[Происхождение и судьба Вселенной]](/books/343338/stiven-hoking-teoriya-vsego-proishozhdenie-i-sudba.webp)








