Александр Китайгородский - Физика для всех. Книга 4. Фотоны и ядра
- Название:Физика для всех. Книга 4. Фотоны и ядра
- Автор:
- Жанр:
- Издательство:Наука
- Год:1982
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Китайгородский - Физика для всех. Книга 4. Фотоны и ядра краткое содержание
Для широкого круга читателей, проявляющих интерес к данной науке.
Физика для всех. Книга 4. Фотоны и ядра - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Важнейшие сведения о структуре Вселенной принесены на Землю световыми лучами звездной материи, находящейся в газообразном состоянии.
В земных условиях нетрудно создать спектры излучения атомов. Атомы заставляют светиться, либо пропуская через газ ток, либо нагревая газ. Следует отметить, что таким способом можно изучать спектры только атомов, но не спектры молекул. Прежде чем газ начнет светиться, молекулы распадутся на атомы. Поэтому, если исследователя интересуют жидкости или твердые тела, то он изучает спектры поглощения. В конечном счете картина определяется системой энергетических уровней. Переходы сверху вниз или снизу вверх несут одинаковые сведения. Надо действовать так, как удобней.
Спектры, состоящие из отдельных четких линий, мы получим лишь от газа или разбавленного раствора. Во 2-й книге говорилось о том, что поведение растворенных молекул напоминает во многих отношениях поведение газа. Это справедливо и для оптической спектроскопии. К сожалению, имеет место влияние растворителя на характер спектра, но, сопоставляя вид спектров молекул, растворенных в разных веществах, можно учесть это влияние и «вытянуть» из эксперимента дактилоскопию растворенной молекулы.
Получить характерный спектр — еще не значит установить систему энергетических уровней молекулы. Однако для многих практических целей это и не требуется. Располагая альбомом, в котором собраны данные о спектрах (т. е. список спектральных линий и их интенсивностей, или кривые зависимости интенсивности от частоты) какого-либо семейства химических веществ, снимая спектр неизвестного вещества и сопоставляя опытную картину картинками из альбома, мы узнаем вещество совершенно таким же образом, как по рисунку бороздок на пальце определяют преступника.
В последнее время оптический спектральный анализ получил соперника в лице радиоспектроскопии. Радиоспектроскопические методы уступают пока что (и это «пока» будет, видимо, длиться недолго) оптическим по чувствительности, но зато в огромное число раз превосходят оптические методы по возможностям идентификации и количественного анализа смесей веществ.
В нашу задачу не входит знакомство с конкретными спектрами веществ. Достаточно познакомить читателя с картиной уровней энергии атомов водорода и припципиальной схемой энергетических уровней свободной молекулы.
На рис. 4.3 изображена система энергетических уровней водорода. Обращаю ваше внимание на характерное сгущение уровней по мере увеличении расстояния от нулевой черты.
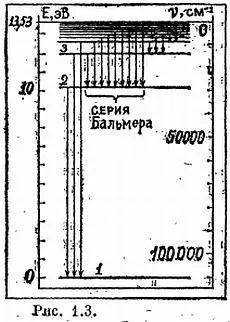
Кстати, не следует думать, что обозначенный на схеме нуль — это «настоящий» нуль. Разумеется, невозбужденный атом водорода обладает определенной энергией. Но поскольку в спектрах проявляются разности энергий, то отсчет удобно вести от нижней черты. В зависимости от силы полученного «щелчка» атом может подняться на любой из «этажей», ненадолго задержаться в этом неравновесном состоянии и далее любым из двух возможных способов (спонтанное или вынужденное излучение) опуститься вниз.
Возникающий спектр удобно разбить на ряд «серий». Каждая серия подчинена своему нижнему уровню. В видимой части лежит так называемая серия Бальмера. Ее объяснение было первым триумфом теории строения атома Нильса Бора.

НИЛЬС БОР(1885–1962) — знаменитый датский физик. Создал первую квантовую модель атома и таким образом открыл закон квантования энергии. Активно участвовал в разработке принципов квантовой механики. Показал принципиальную неприменимость к микромиру понятий подходящих для описания поведения макроскопических тел. Внес большой вклад в теорию строения атомного ядра.
Не все энергетические переходы равновероятны. Чем выше вероятность перехода, тем сильнее соответствующая линия. Есть и запрещенные переходы.
Большим торжеством физиков-теоретиков явилось то, что они исчерпывающим образом объяснили спектр атомов водорода, решая знаменитое уравнение квантовой механики, выведенное в 1926 г. Эрвином Шредингером.
На спектры атомов влияют внешние поля. Линии расцепляются на несколько компонент под действием электрического поля (эффект Штарка) и под действием магнитного (эффект Зеемана). Мы не станем объяснять эти интересные явления. Скажем лишь, что разобраться в некоторых из них удалось только после того, как Гаудсмит и Уленбек предположили, что электрон обладает спином. О том, как спин обнаруживает себя в опытах непосредственно, уже говорилось в 3-й книге.
И, наконец, последнее замечание, касающееся картинки энергетических уровней. Мы видим, что предел, к которому подходят уровни, обозначен числом 13,53. Что это за число? Это ионизационное напряжение. Если помножить заряд электрона на величину этого напряжения в вольтах, то мы получим величину работы, которую надо затратить, чтобы оторвать электрон от ядра, иными словами, чтобы разрушить атом водорода.
Спектры атомов возникают в результате электронных переходов. Как только мы переходим от атомов к молекуле, сразу же возникает необходимость в учете еще двух составляющих энергии. Молекула может вращаться, атомы молекулы могут совершать колебания по отношению друг к другу. Все эти виды энергии тоже квантуются, они могут иметь лишь определенные дискретные значения. Таким образом, энергетическое состояние молекулы описывается состоянием ее электронного облака (электронный уровень), состоянием колебательного движения (колебательный уровень) и состоянием вращения (вращательный уровень). Приходится оперировать тремя типами данных — так сказать, номером дома, этажа и квартиры.
Но что играет роль этажа, а что — квартиры? Какие энергетические уровни разделены большими промежутками, а какие малыми? На эти вопросы отвечает рис. 1.4.
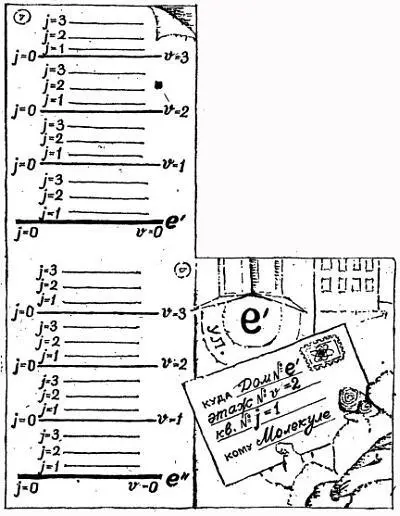
На схеме показаны два электронных уровня е ' и е ' (номера домов). Этажи — колебательные уровни — помечены буквой v , а номера квартир — вращательные уровни — буквой j . Правда, такая нумерация домов не принята. Используется, как известно, сплошная нумерация квартир, а мы при описании спектров молекулы нумеруем квартиры на каждом этаже, начиная с нуля.
Как видите, промежутки между вращательными уровнями самые маленькие, а наибольшей является разность между электронными уровнями ( е ' и е ").
Положим, у молекулы возможны электронные уровни, лежащие при 100, 200, 300…. единицах энергии, колебательные уровни — при 10, 20, 30…. единицах, вращательные — при 1, 2, 3…. единицах; тогда молекула, находящаяся на втором электронном уровне, первом колебательном и третьем вращательном, будет иметь энергию 213 единиц.
Читать дальшеИнтервал:
Закладка:









