Jaume Navarro - Квантовая модель атома. Нильс Бор. Квантовый загранпаспорт.
- Название:Квантовая модель атома. Нильс Бор. Квантовый загранпаспорт.
- Автор:
- Жанр:
- Издательство:Де Агостини
- Год:2014
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Jaume Navarro - Квантовая модель атома. Нильс Бор. Квантовый загранпаспорт. краткое содержание
Квантовая модель атома. Нильс Бор. Квантовый загранпаспорт. - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Наряду с предложениями возглавить кафедры других университетов Бор также постоянно получал приглашения читать лекции или краткие курсы во многих европейских учреждениях. Его живой и воодушевляющий стиль привлекал молодых исследователей, искавших собеседников, которые объяснили бы им суть зарождавшейся квантовой физики, на что предыдущее поколение профессоров не всегда было способно. Бор поддерживал диалог с начинающими учеными в поисках новых идей и возможных талантов. Так подобрался целый ряд подающих надежды молодых людей, которых он приглашал в Копенгаген. Многие из них стали главными действующими лицами в физике 1920-х годов.
Вольфганг Паули (1900-1958) был одним из первых (и одним из самых молодых) людей, кто воспользовался гостеприимством Бора. Паули, родившийся в Вене, решил изучать физику в Мюнхенском университете, где Зоммерфельд сразу же признал его талант. Действительно, всего лишь через три года после начала обучения Паули получил степень доктора за свои работы по теории относительности, обратившие на себя внимание самого Эйнштейна. Его первая исследовательская должность была в Гёттингене, где отделением теоретической физики руководил Макс Борн (1882-1970), там же он присутствовал на семинаре, который проводил Бор. Через несколько лет Паули вспоминал: «Когда я лично познакомился с Бором, начался новый этап моей научной жизни». Ему было всего 22 года, когда знаменитый датчанин, увидев, что один из его интересов составляет проблема эффекта Зеемана, пригласил молодого человека провести год в Копенгагене.
Другим молодым ученым, которого принимал Бор, был Вернер Гейзенберг (1901-1976). В возрасте 23 лет он уже опубликовал дюжину статей об атоме Бора в связи с гелием и эффектом Зеемана и занимал должность преподавателя (приват-доцента) в Геттингене. Некоторые из этих статей были плодами его сотрудничества с Зоммерфельдом в Мюнхене и с Борном в Гёттингене. Бор и Гейзенберг очень интенсивно общались, прекрасно понимая и дополняя друг друга. Гейзенберг в итоге провел много времени в Копенгагене, как он вспоминал годы спустя, ото было единственное место, где можно было насытиться духом квантовой физики».

Арнольд Зоммерфельд и Нильс Бор, 1919 год.

Ученый с пятью сыновьями. Рядом с ним — Оге, лауреат Нобелевской премии по физике 1975 года.
Это чрезвычайно точное определение, ведь после первого пребывания в столице Дании Паули и Гейзенберг изобрели квантовую механику, абсолютно новый способ понимания атомных явлений. Ключевой поворот, который совершили исследователи и увлекли за собой всех физиков, состоял в том, чтобы перестать думать об электронных орбитах и отказаться от принципа соответствия Бора, вынуждавшего представлять структуру атома, к которой до той поры не применялись квантовые ограничения. Новая квантовая механика делала шаг, на который не решился Бор. Требовалось полностью отказаться от любой попытки визуализировать атомные орбиты и сосредоточиться только на наблюдаемых свойствах электронов. Наблюдаемыми были свойства, полученные благодаря атомным спектрам и увеличивающимся объемам информации, которую давала радиоактивность и другие виды излучения.
Паули отказался от назначения квантовых чисел переходам между возможными электронными орбитами и переключился на присвоение каждому атомному электрону метки (сочетания трех квантовых чисел, которые использовали Бор и Зоммерфельд), установив, что в каждом атоме не может быть двух электронов с одной и той же меткой. Так, если в модели Бора — Зоммерфельда три квантовых числа относились к переходу энергии, эксцентриситету и прецессии возможных орбит вокруг ядра, то для Паули эти три квантовых числа были только величинами, которые применяются к каждому электрону. Понятие орбиты исчезло, но теоретические прогнозы совпадали с экспериментальными результатами.
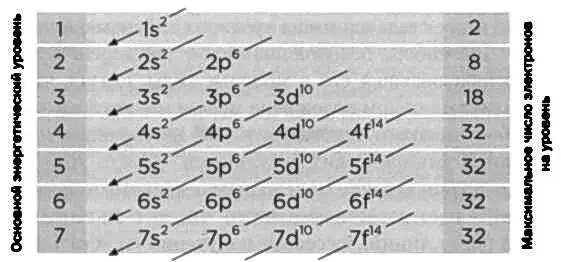
Представим себе атом с большим числом электронов. Как они распределяются вокруг ядра? Если отказаться от понятия орбиты, траектории электронов нарисовать уже нельзя, но, следуя постулатам новой квантовой механики, можно назначить им квантовые числа. Числа, косвенно отражающие уровни энергии. Любая физическая система стремится к состоянию наименьшей энергии. Если бы это было так, все электроны в стабильном атоме стремились бы к одному и тому же уровню, самому низкому. Принцип Паули запрещает именно это: не может быть двух электронов с одинаковыми квантовыми числами. Так электроны постепенно заполнят различные уровни (орбитали), начиная с самой низкой энергии. По этому правилу, орбитальная структура следует порядку стрелок на прилагаемом рисунке. Целые числа 1, 2, 3... представляют первое квантовое число, которое Бор ввел в 1913 году. Буквы s, р, d, f... представляют, в свою очередь, два квантовых числа, которые ввел Зоммерфельд: s изначально соответствовало круговой орбите; р — трем орбитам с одним и тем же эксцентриситетом, но с различными прецессиями; d — пяти орбитам, f— семи. Наконец, благодаря спиновому квантовому числу на каждой из этих орбиталей может быть по два электрона, один с положительным спином, а другой с отрицательным. Например, в случае с атомом меди, содержащим 29 электронов, его электронная конфигурация будет следующей:
1s 2, 2s 2, 2p 6, 3s 2, 3p 6, 4s 2, 3d 9.
Если сложить верхние индексы, мы увидим, что общее число электронов в сумме дает 29.
Единственная проблема, с которой столкнулся Паули, состояла в необходимости введения четвертого квантового числа, которое полностью объясняло эффект Зеемана, как нормальный, так и аномальный. Паули никак не истолковал это число, но двое молодых исследователей из Лейдена, Джордж Уленбек (1900-1988) и Сэмюэл Гаудсмит (1902-1978), решили, что это четвертое квантовое число можно считать четвертой степенью свободы электрона, чем-то вроде внутреннего вращения, аналогичного вращательному движению планет вокруг своей оси. По данной причине это четвертое атомное число было названо спином (от английского spin — «вращаться»).
Все вышесказанное подводит нас к принципу запрета Паули: в одной и той же системе, в одном и том же атоме каждый электрон должен отличаться от всех остальных; его четыре квантовых числа не могут совпадать. Это объясняет, например, что в самом низком состоянии энергии любого атома все электроны не могут находиться на первом орбитальном уровне, они распределяются по возрастающим уровням энергии и квантовым числам.
Читать дальшеИнтервал:
Закладка: