Леонид Пономарев - По ту сторону кванта
- Название:По ту сторону кванта
- Автор:
- Жанр:
- Издательство:Молодая гвардия
- Год:1971
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Леонид Пономарев - По ту сторону кванта краткое содержание
Эта книга не для знатоков, хотя и они найдут здесь несколько неожиданных фактов. Она для тех, кто заканчивает школу, и для тех, кто пытается посмотреть на мир немного шире, чем позволяет им их специальность — необходимо узкая, чтобы быть продуктивной.
В предлагаемой книге история атома рассказана вполне строго. Но строгость в ней не самоцель: как правило, нам интересны не только сами факты, но и их толкование и обстоятельства, при которых они открыты. Поэтому главное в книге — эволюция идей и понятий атомной физики, образующих единую систему — простую и гармоничную. Именно эта внутренняя красота была побудительной причиной появления книги. Я буду считать свою работу не напрасной, если прочитавший ее почувствует силу логических построений квантовой механики и красоту их неожиданно простых следствий.
По ту сторону кванта - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Нильс Бор всю жизнь провел среди парадоксов квантовой механики, но даже его поразила реальность происходящего: он заплакал от удивления и благодарности.
ВОКРУГ КВАНТА
ОПЫТНОЕ ДОКАЗАТЕЛЬСТВО ПОСТУЛАТОВ БОРА
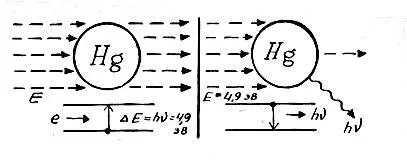
Опыт Франка и Герца, по существу, очень похож на опыт Кирхгофа и Бунзена, только атомы натрия в нем они заменили атомами ртути, а вместо луча направили на них пучок электронов, энергию которых они могли менять. При этом Франк и Герц наблюдали интересное явление: пока энергия электронов была произвольной — число электронов, прошедших через атомы ртути, было равно числу электронов исходного пучка. Когда же энергия их достигала определенной величины (в опытах она равнялась 4,9 электрон-вольта, или 7,84 10 -12эрг), число электронов, прошедших ртуть, резко падало — они поглощались атомами ртути. Одновременно с этим в спектре паров ртути вспыхивала яркая фиолетовая линия с длиной волны λ = 2536Ǻ, то есть с частотой ν = 1,18 • 10 15сек -1. Энергию кванта с такой частотой легко вычислить — она равна E = hν = 6,62 • 10 -27• 1,2 • 10 15= 7,82 • 10 -12эрг, то есть почти точно равна затраченной энергии электрона. Очевидно, это излучение возникает при обратном переходе атома ртути из возбужденного состояния в основное.
Легко видеть, что наблюдаемая картина — прямое опытное доказательство обоих постулатов Бора: в атоме реально существуют стационарные состояния, и поэтому он не способен поглощать произвольные порции энергии. Переходы электрона между уровнями в атоме возможны только скачками, а частота излучаемых квантов определяется разностью энергии уровней и вычисляется по формуле Эйнштейна ΔЕ = hν. Конечно, «легко видеть» это только сейчас, а в 1913 году даже сами Франк и Герц объяснили свой опыт совсем по-другому.
«КВАНТОВАНИЕ» СОЛНЕЧНОЙ СИСТЕМЫ
Мы много раз сравнивали атом с солнечной системой, хотя и не придавали глубокого смысла этой аналогии. Тем более неожиданно, что солнечная система, как и атом, тоже подчиняется некоему «правилу квантования». Это правило не имеет ничего общего с квантовой механикой, но тем не менее любопытно, что расстояния планет от Солнца (как и радиусы орбит в атоме) меняются не беспорядочно, а подчиняются довольно строгому закону.
Факт этот был известен Иоганну Кеплеру, и еще в молодости, много размышляя о «гармонии сфер», он пришел к выводу, что в промежутках между сферами, построенными на орбитах планет, можно вписать пять правильных многогранников.
Профессор Даниэль Тициус в 1772 году выпустил в Бонне книгу «Созерцание природы», в которой привел табличку расстояний от Солнца до планет в условных единицах (расстояние до ближайшей к Солнцу планеты Меркурий принято за 4).
Меркурий… 4 = 4;
Венера…… 7 = 4 + 1 3;
Земля……. 10 = 4 + 2 3;
Марс…….. 16 = 4 + 4 3;
Юпитер…… 52 = 4 + 16 3;
Сатурн…… 100 = 4 + 32 3.
Позднее прибавился
Уран……. 196 = 4 + 64-3.
Впоследствии Боде уточнил закон Тициуса, приняв расстояние до Меркурия за 8 условных единиц и записав общую формулу для планетных расстояний в виде: R = 8 + 3 2 n,
где п = 0, 1, 2, 3, 4, 6, 7, 8.
Замечательно, что в приведенной схеме нет планеты с номером n = 5, которая должна была бы помещаться между Марсом и Юпитером. Но как раз в этом месте расположен пояс астероидов — малых планет. По мнению астрономов, это осколки некогда существовавшей большой планеты Фаэтон.
Закон Тициуса и Боде еще до конца не понят, хотя существует несколько его доказательств (одно из них принадлежит советскому ученому Отто Юльевичу Шмидту). По-видимому, полное объяснение закону будет найдено вместе с разгадкой происхождения нашей солнечной системы.
ГЛАВА ПЯТАЯ
Представьте, что вы решили изучить жизнь клетки. Вы ставите над нею всевозможные опыты: нагреваете, облучаете, разрушаете и тщательно рассматриваете в микроскоп. Однако все ваши знания о ней будут неполны, пока вы не вспомните, что клетка — это часть живого организма и только в нем проявляет всю полноту своих свойств.
Нечто похожее произошло и в науке об атоме. До сих пор мы намеренно пытались изолировать атом и отбирали только те опыты, которые могут прояснить свойства отдельного атома. Однако задолго до всех этих опытов, которые доказали сложную структуру атома, Дмитрий Иванович Менделеев (1834–1907) установил, что атомы различных элементов образуют единый организм — естественную систему элементов.
Через год после создания периодической системы элементов он писал:
«Легко предположить, но ныне пока еще нет возможности доказать, что атомы простых тел суть сложные вещества, образованные сложением некоторых еще меньших частей (ультиматов), что называемое нами неделимым (атом) — неделимо только обычными химическими силами… однако, несмотря на шаткость и произвольность такого предположения, к нему невольно склоняется ум при знакомстве с химией. Оттого такое учение повторяется в разных формах уже давно, и выставленная мной периодическая зависимость между свойствами и весом, по-видимому, подтверждает такое предчувствие, если можно так выразиться, столь свойственное химикам».
Надо сказать, что химиков никогда не могла удовлетворить мысль о независимом множестве качественно различных элементов. Поэтому они всегда стремились свести их качественное многообразие к простой и ясной идее; атомы различных элементов представляют собой различные скопления частиц одного и того же рода.
Такие попытки начались уже в древности и в дальнейшем развивались по двум различным путям.
Демокрит верил, что все вещества в природе построены из атомов, а свойства веществ зависят от различных сочетаний атомов.
Аристотель утверждал, что все сущее состоит из элементов, которые сами являются носителями определенных качеств.
Отголосок этого давнего спора дошел даже до наших дней: при слове «атом» у нас невольно возникает зрительный образ чего-то твердого и массивного; при словах «химический элемент» мы пытаемся представить себе некое чистое качество, безотносительно к его носителю. Быть может, поэтому учение о химических элементах вначале развивалось совершенно независимо от идеи об атомах. Впоследствии оба учения так переплелись, что их перестали различать, но, как мы только что убедились, до сих пор не удалось преодолеть психологический барьер между ними.
Читать дальшеИнтервал:
Закладка:









